罕見病新(xīn)藥「炸裂之月」
發布日期:2024-03-13 閱讀次數:865 作(zuò)者:宇舟 來源:藥智網
摘要:
2月,可(kě)謂是罕見病新(xīn)藥的「炸裂之月」。
據悉,2024年2月29日是第十七個國(guó)際罕見病日,而2月的獲得NMPA批準上市的罕見病新(xīn)藥就有4款,再掀小(xiǎo)高潮。
除了罕見病新(xīn)藥外,不用(yòng)冷藏、不含輔助蛋白的第五款肉毒素——Xeomin(西馬)也成功上市。
以下為(wèi)2月CDE藥審報告分(fēn)析。
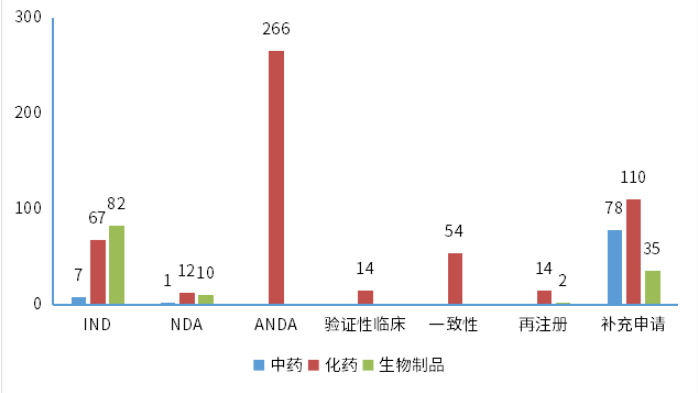
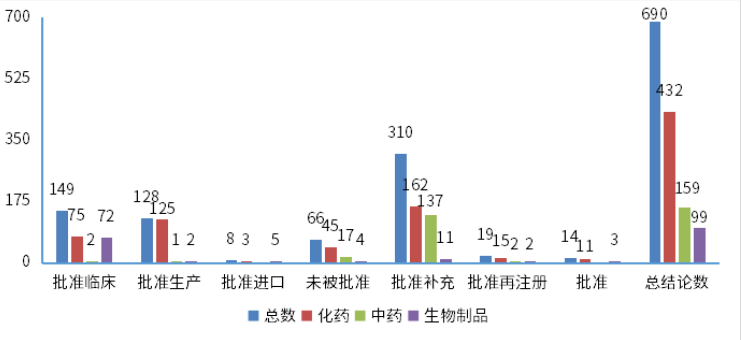
根據藥智數據企業版——藥品注冊與受理(lǐ)數據庫最新(xīn)統計,2024年2月份CDE共承辦新(xīn)的藥品注冊申請以品種(按藥品+企業維度)統計共有911個,同比減少23.45%,其中化藥615個品種,中藥163個品種,生物(wù)制品133個品種,以受理(lǐ)号計共1215個。以注冊申請審評任務(wù)類型統計,受理(lǐ)新(xīn)藥臨床試驗申請(以下簡稱IND)156個品種(受理(lǐ)号245個);新(xīn)藥上市許可(kě)申請(以下簡稱NDA)23個品種(受理(lǐ)号34個);同名同方藥、仿制藥、生物(wù)類似藥上市許可(kě)申請(以下簡稱ANDA)266個品種(受理(lǐ)号316個);仿制藥質(zhì)量和療效一緻性評價注冊申請(該注冊申請類别以下簡稱一緻性評價申請)54個品種(受理(lǐ)号79個);各申請類别注冊申請受理(lǐ)品種情況詳見圖1。2024年2月份(注:狀态開始時間(藥智)從2024年2月1日至2024年2月29日)完成審評的品種共714個(受理(lǐ)号980個),同比增長(cháng)10.19%。其中化藥完成審評443個品種,中藥審評完成162個品種,生物(wù)制品完成審評109個品種。(注:完成審評的數據統計截至2024年3月11日)藥智收錄到結論的數量為(wèi)690個品種(950個受理(lǐ)号),對有結論的藥品類型進行分(fēn)析統計,其中中藥品種159個(163個受理(lǐ)号),化藥品種432個(649個受理(lǐ)号),生物(wù)制品品種99個(138個受理(lǐ)号)。2024年2月注冊申請完成審評結論品種統計詳情情況見圖2。創新(xīn)藥、改良型新(xīn)藥及進口原研藥品分(fēn)析2024年2月份,1類創新(xīn)藥注冊申請受理(lǐ)132個品種(受理(lǐ)号206個),以注冊申請審評任務(wù)分(fēn)類統計,IND申請127個品種(受理(lǐ)号197個);NDA申請5個品種(受理(lǐ)号9個)。改良型新(xīn)藥注冊申請受理(lǐ)32個品種(受理(lǐ)号54個),以藥品類型分(fēn)類統計,改良型中藥受理(lǐ)1個品種(受理(lǐ)号1個),改良型化學(xué)藥20個品種(受理(lǐ)号35個),改良型生物(wù)制品11個品種(受理(lǐ)号18個)。适應症包含抗腫瘤領域、消化道及代謝(xiè)等。2024年2月創新(xīn)藥與改良型新(xīn)藥注冊申請受理(lǐ)情況詳見表一,2024年2月注冊申請受理(lǐ)創新(xīn)藥、改良型新(xīn)藥ATC分(fēn)布情況詳見圖3。表一 2024年2月創新(xīn)藥與改良型新(xīn)藥注冊申請受理(lǐ)情況
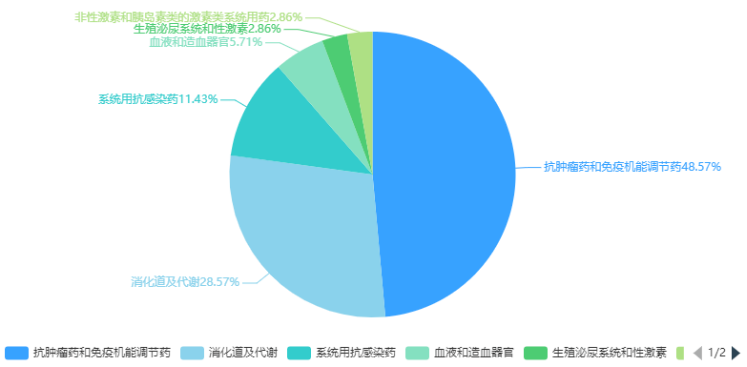
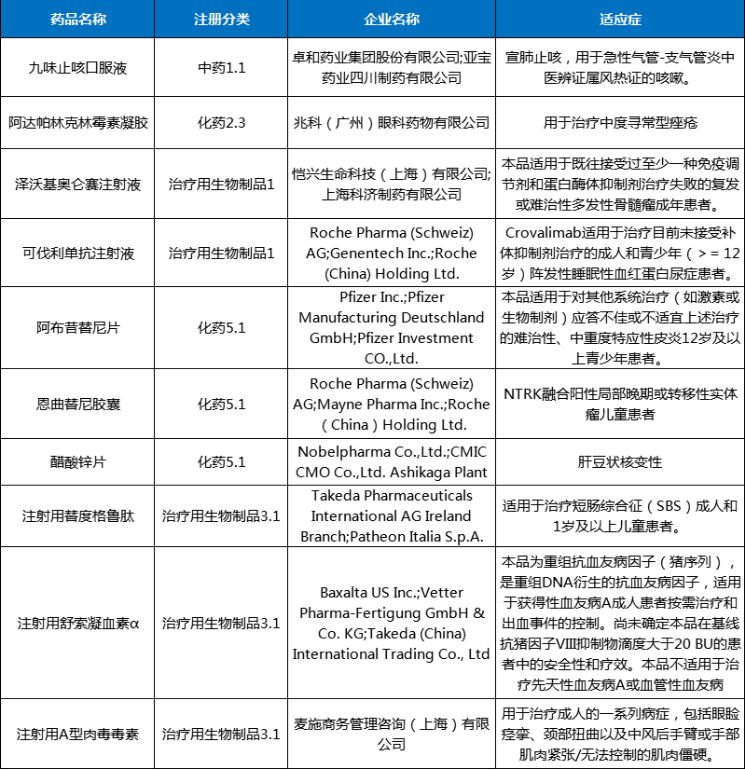
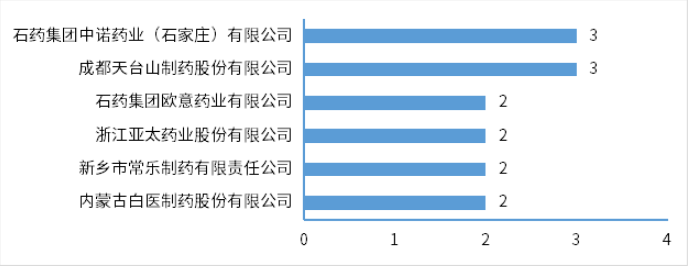
圖3 2024年2月注冊申請受理(lǐ)創新(xīn)藥、改良型新(xīn)藥ATC分(fēn)布情況2024年2月份,創新(xīn)藥與改良型新(xīn)藥獲批上市共計4個品種(受理(lǐ)号4個),分(fēn)别是中藥1.1類的九味止咳口服液、化藥2.3類的阿達帕林克林黴素凝膠、治療用(yòng)生物(wù)制品1類的澤沃基奧侖賽注射液和可(kě)伐利單抗注射液。2月份進口原研藥品上市品種有6個,其中化藥3個品種,生物(wù)制品3個品種。2024年2月創新(xīn)藥與改良型新(xīn)藥以及進口原研藥品獲批上市品種情況詳見表二。表二 2024年2月創新(xīn)藥、改良型新(xīn)藥及進口原研藥品獲批上市情況2024年2月29日是第十七個國(guó)際罕見病日,罕見病(Rare Diseases)通常是指發病率很(hěn)低的疾病,世界衛生組織将患病人數占總人口0.065%-0.1%之間的疾病定義為(wèi)罕見病。在剛剛過去2月獲得NMPA批準上市的可(kě)伐利單抗注射液、注射用(yòng)舒索凝血素α等罕見病新(xīn)藥為(wèi)部分(fēn)罕見病患者帶來了新(xīn)選擇。陣發性睡眠性血紅蛋白尿症(PNH),是一種罕見且危及生命的血液疾病,患病後,患者的紅細胞會被補體(tǐ)系統(天然免疫系統的一部分(fēn))破壞,在沒有接受補體(tǐ)抑制劑治療的情況下,患者5年内死亡的風險達35%。可(kě)伐利單抗注射液是一種靶向補體(tǐ)蛋白C5的重組人源化IgG1亞型單克隆抗體(tǐ),能(néng)特異性地與補體(tǐ)蛋白C5結合,抑制補體(tǐ)途徑免疫反應。獲得性血友病A,該病年發病率約為(wèi)1.5/100萬,該病死亡率為(wèi)6.7%,主要死亡原因包括出血、基礎疾病以及繼發于免疫抑制治療的嚴重感染等。注射用(yòng)舒索凝血素α是一款重組抗血友病因子(豬序列),是重組DNA衍生的抗血友病因子,與人序列凝血因子Ⅷ結構相似,序列同源,而且不容易受到抗人FⅧ自身抗體(tǐ)的滅活,可(kě)以替代人FⅧ發揮明顯的止血作(zuò)用(yòng)。肝豆狀核變性(又稱Wilson病,威爾遜病),是一種常染色體(tǐ)隐性遺傳病。該病發病年齡多(duō)為(wèi)3-60歲,兒童患者多(duō)以肝髒受累為(wèi)首發表現。醋酸鋅片是一種銅吸收抑制劑,可(kě)阻止吸收來自飲食的銅,同時阻止内源性銅(來自唾液、膽汁、胃液)的重吸收。2024年2月份,CDE共将1個品種納入拟優先審評品種公示名單,以及有4個品種正式納入優先審評,納入理(lǐ)由包含納入突破性治療藥物(wù)程序、符合附條件批準的藥品以及其他(tā)優先審評審批情況;3個品種(受理(lǐ)号CXSL2000087、JXSL2300147、JXSL2300148、JXSL2300004)納入突破性治療品種名單。2024年2月優先審評與突破性治療品種名單詳見表三。2024年2月份,CDE共受理(lǐ)一緻性評價品種54個(受理(lǐ)号79個),石藥集團中諾藥業(石家莊)有限公司申報有注射用(yòng)阿莫西林鈉克拉維酸鉀、注射用(yòng)頭孢哌酮鈉舒巴坦鈉、注射用(yòng)頭孢米諾鈉3個品種,與申報硫酸阿米卡星注射液、鹽酸納洛酮注射液、注射用(yòng)生長(cháng)抑素3個品種的成都天台山制藥股份有限公司,是2月份申報一緻性評價最多(duō)品種的兩個公司。2024年2月各企業申報一緻性評價品種TOP6見圖4。一緻性評價完成審評品種46個(受理(lǐ)号67個),天津金耀藥業有限公司的鹽酸甲氧氯普胺注射液、國(guó)藥一心制藥有限公司的注射用(yòng)達卡巴嗪、雙鶴藥業(海南)有限責任公司的氯氮平口腔崩解片、安(ān)徽貝克生物(wù)制藥有限公司的齊多(duō)拉米雙夫定片4個品種為(wèi)首家通過一緻性評價。其中齊多(duō)拉米雙夫定片已在2021年3月由上海迪賽諾生物(wù)醫(yī)藥有限公司獲批首家視同通過一緻性評價。2024年2月通過一緻性評價品種名單詳見表四。