2021年度藥品審評報告
發布日期:2022-06-02 閱讀次數:12645 來源:國(guó)家藥品監督管理(lǐ)局
摘要:
2021年是黨和國(guó)家曆史上具有裏程碑意義的一年。以習近平同志(zhì)為(wèi)核心的黨中央團結帶領全黨全國(guó)各族人民(mín),隆重慶祝中國(guó)共産黨成立一百周年,勝利召開黨的十九屆六中全會、制定黨的第三個曆史決議,如期打赢脫貧攻堅戰,如期全面建成小(xiǎo)康社會、實現第一個百年奮鬥目标,開啓全面建設社會主義現代化國(guó)家、向第二個百年奮鬥目标進軍新(xīn)征程。在“十四五”開局之年,作(zuò)為(wèi)我國(guó)負責藥品注冊上市的專職技(jì )術審評機構,國(guó)家藥品監督管理(lǐ)局藥品審評中心(以下簡稱藥審中心)始終堅決貫徹落實習近平總書記重要講話和重要指示精(jīng)神,全面踐行“四個最嚴”要求,牢記保護和促進公衆健康初心使命,堅持人民(mín)至上、生命至上和科(kē)學(xué)審評,積極投身藥品審評審批制度改革事業,緊緊圍繞人民(mín)生命健康、世界科(kē)技(jì )前沿、國(guó)家重大需求等戰略目标,在體(tǐ)制機制、技(jì )術标準、流程管理(lǐ)、隊伍建設等方面加快創新(xīn)融合步伐。
面對複雜嚴峻的疫情防控形勢和極為(wèi)艱巨繁重的藥品審評任務(wù),藥審中心在國(guó)家藥品監督管理(lǐ)局黨組的堅強領導下,以習近平新(xīn)時代中國(guó)特色社會主義思想為(wèi)指導,深入學(xué)習貫徹黨的十九屆五中、六中全會精(jīng)神和“七一”重要講話精(jīng)神,認真落實黨中央、國(guó)務(wù)院決策部署,推動全面從嚴治黨不斷向縱深發展,認真開展好黨史學(xué)習教育和“我為(wèi)群衆辦實事”實踐活動,全力推進新(xīn)冠病毒疫苗藥物(wù)應急審評審批,推動2款國(guó)産新(xīn)冠病毒疫苗接連被納入世界衛生組織(WHO)緊急使用(yòng)清單(EUL),應急審評通過一組新(xīn)冠病毒中和抗體(tǐ)聯合治療藥物(wù)上市,着力建設公開透明的審評機制,多(duō)措并舉支持兒童用(yòng)藥研發創新(xīn),人民(mín)獲得感、幸福感、安(ān)全感顯著增強。
2021年審評通過47個創新(xīn)藥,再創曆史新(xīn)高,臨床急需境外新(xīn)藥上市持續加快,優先審評效率大幅提高,仿制藥質(zhì)量和療效一緻性評價工作(zuò)紮實推進,臨床試驗管理(lǐ)躍上新(xīn)台階,核查檢驗協調機制更加通暢,實施藥品電(diàn)子通用(yòng)技(jì )術文(wén)檔申報,中國(guó)上市藥品專利信息登記平台建設運行,完成中藥“三方”抗疫成果轉化,完善符合中醫(yī)藥特點的審評技(jì )術标準體(tǐ)系,支持和推動中藥傳承創新(xīn)發展,持續深化ICH工作(zuò),保障國(guó)家藥品監督管理(lǐ)局成功連任ICH管理(lǐ)委員會成員,發布87個技(jì )術指導原則,審評标準體(tǐ)系更加完備,流程導向審評體(tǐ)系更加科(kē)學(xué),審評體(tǐ)系和審評能(néng)力現代化建設持續推進,醫(yī)藥産業創新(xīn)能(néng)力和高質(zhì)量發展進一步增強。
第一章 藥品注冊申請受理(lǐ)情況
(一)總體(tǐ)情況
1.全年受理(lǐ)情況
2021年,國(guó)家藥品監督管理(lǐ)局藥品審評中心(以下簡稱藥審中心)受理(lǐ)注冊申請11658件1,同比增長(cháng)13.79%。
受理(lǐ)需技(jì )術審評的注冊申請9235件,同比增長(cháng)29.11%,包括需經技(jì )術審評後報送國(guó)家局2審批(以下簡稱技(jì )術審評)的注冊申請2180件,需經技(jì )術審評後以國(guó)家局名義作(zuò)出行政審批(以下簡稱審評審批)的注冊申請7051件,需經技(jì )術審評後送國(guó)家藥品監督管理(lǐ)局醫(yī)療器械技(jì )術審評中心、以醫(yī)療器械作(zuò)用(yòng)為(wèi)主的藥械組合(以下簡稱藥械組合)産品的注冊申請4件。
受理(lǐ)無需技(jì )術審評直接以國(guó)家局名義作(zuò)出行政審批3(以下簡稱直接審批)的注冊申請2423件。2017-2021年注冊申請受理(lǐ)量詳見圖1。
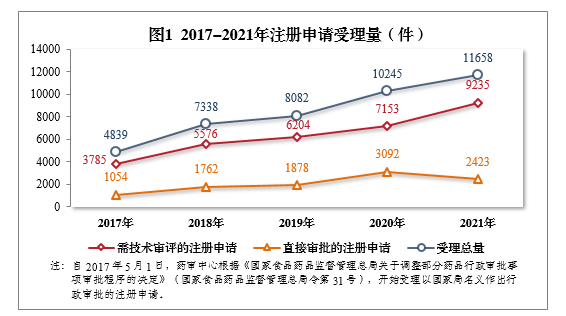
根據《國(guó)家藥監局關于進一步完善藥品關聯審評審批和監管工作(zuò)有關事宜的公告》(2019年第56号,以下簡稱56号公告)要求,2021年受理(lǐ)原料藥注冊申請1313件,同比增長(cháng)2.98%。
2.需技(jì )術審評的各類注冊申請受理(lǐ)情況
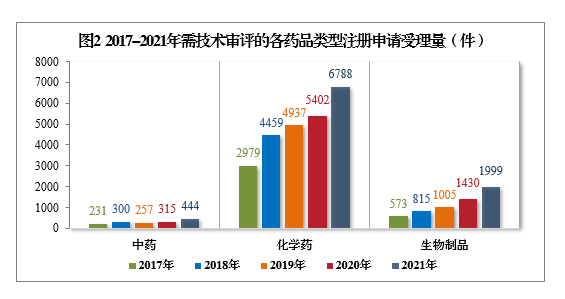
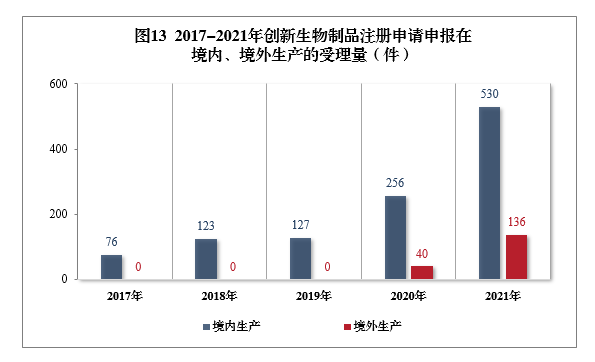
2021年受理(lǐ)的需技(jì )術審評的9231件4注冊申請中,以藥品類型統計,中藥5注冊申請444件,同比增長(cháng)40.95%;化學(xué)藥注冊申請為(wèi)6788件,同比增長(cháng)25.66%,占全部需技(jì )術審評的注冊申請受理(lǐ)量的73.53%;生物(wù)制品注冊申請1999件,同比增長(cháng)39.79%。2017-2021年需技(jì )術審評的各藥品類型注冊申請受理(lǐ)量詳見圖2。
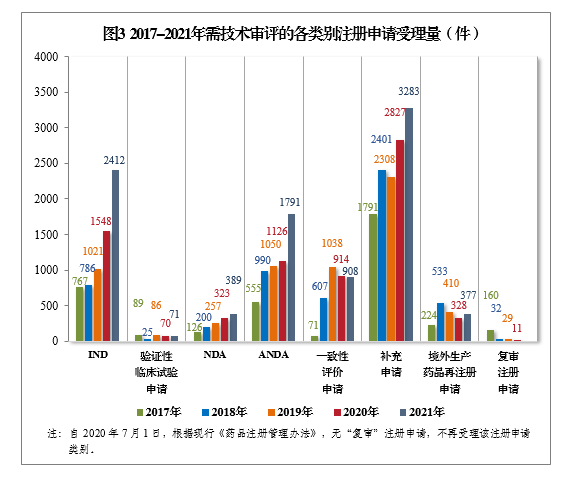
以注冊申請類别統計,受理(lǐ)新(xīn)藥臨床試驗申請(該注冊申請類别以下簡稱IND)2412件,同比增長(cháng)55.81%;新(xīn)藥上市許可(kě)申請(該注冊申請類别以下簡稱NDA)389件,同比增長(cháng)20.43%;同名同方藥、仿制藥、生物(wù)類似藥上市許可(kě)申請(該注冊申請類别以下簡稱ANDA)1791件,同比增長(cháng)59.06%;仿制藥質(zhì)量和療效一緻性評價注冊申請6(該注冊申請類别以下簡稱一緻性評價申請)908件;補充申請3283件,同比增長(cháng)16.13%。2017-2021年需技(jì )術審評的各類别注冊申請受理(lǐ)量詳見圖3。
(二)創新(xīn)藥注冊申請受理(lǐ)情況
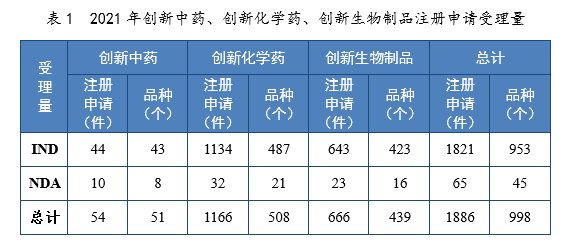
2021年受理(lǐ)創新(xīn)藥7注冊申請1886件(998個品種8),同比增長(cháng)76.10%。
以藥品類型統計,創新(xīn)中藥54件(51個品種),同比增長(cháng)134.78%;創新(xīn)化學(xué)藥1166件(508個品種),同比增長(cháng)55.05%;創新(xīn)生物(wù)制品666件(439個品種),同比增長(cháng)125.00%。
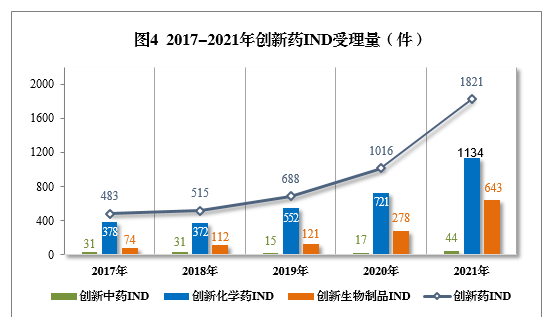
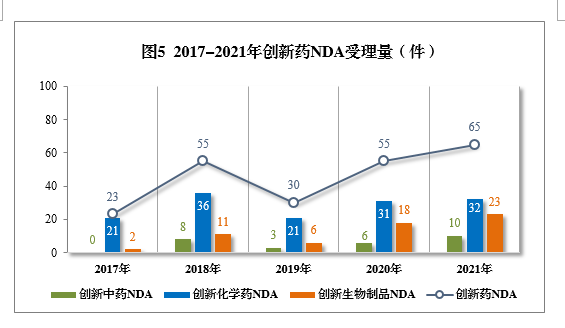
以注冊申請類别統計,IND 1821件(953個品種),同比增長(cháng)79.23%;NDA 65件(45個品種),同比增長(cháng)18.18%。
2021年創新(xīn)中藥、創新(xīn)化學(xué)藥、創新(xīn)生物(wù)制品注冊申請受理(lǐ)量詳見表1,2017-2021年創新(xīn)藥IND受理(lǐ)量詳見圖4,2017-2021年創新(xīn)藥NDA受理(lǐ)量詳見圖5。
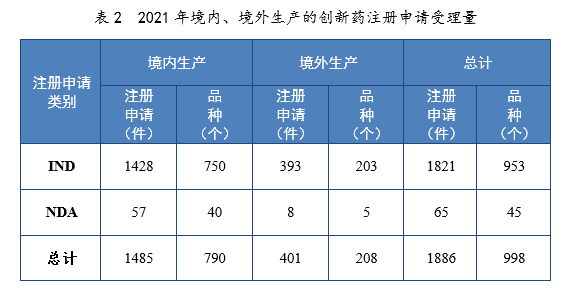
以生産場地類别統計,境内生産創新(xīn)藥1485件(790個品種),境外生産創新(xīn)藥401件(208個品種)。2021年境内、境外生産的創新(xīn)藥注冊申請受理(lǐ)量詳見表2。
(三)需技(jì )術審評的中藥注冊申請受理(lǐ)情況
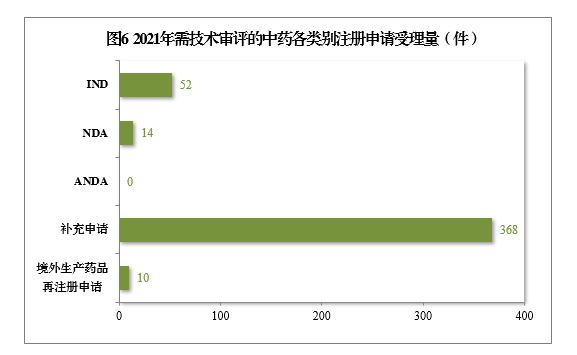
2021年受理(lǐ)需技(jì )術審評的中藥注冊申請444件。以注冊申請類别統計,IND 52件,同比增長(cháng)136.36%,包括創新(xīn)中藥IND 44件(43個品種),同比增長(cháng)158.82%;NDA 14件,同比增長(cháng)133.33%,包括創新(xīn)中藥NDA 10件(8個品種),同比增長(cháng)66.67%。
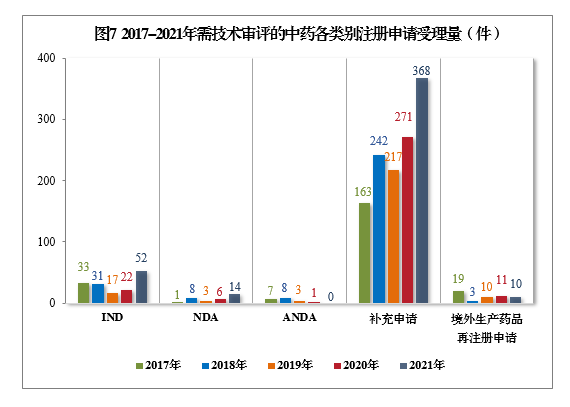
2021年需技(jì )術審評的中藥各類别注冊申請受理(lǐ)量詳見圖6。2017-2021年需技(jì )術審評的中藥各類别注冊申請受理(lǐ)量詳見圖7。
(四)需技(jì )術審評的化學(xué)藥注冊申請受理(lǐ)情況
2021年受理(lǐ)需技(jì )術審評的化學(xué)藥注冊申請6788件。以注冊申請類别統計,IND 1500件,同比增長(cháng)58.56%,包括創新(xīn)化學(xué)藥IND 1134件(487個品種),同比增長(cháng)57.28%;NDA 197件,同比增長(cháng)3.14%,包括創新(xīn)化學(xué)藥NDA 32件(21個品種),同比增長(cháng)3.23%;化學(xué)藥5.1類9注冊申請169件,同比增長(cháng)5.63%,其中臨床試驗申請10共44件,NDA 125件;ANDA 1791件,同比增長(cháng)59.20%;一緻性評價申請908件。
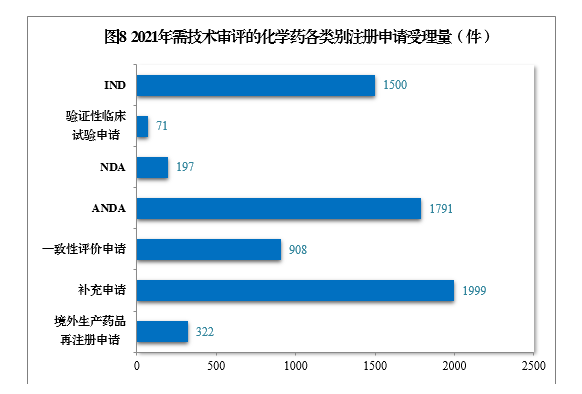
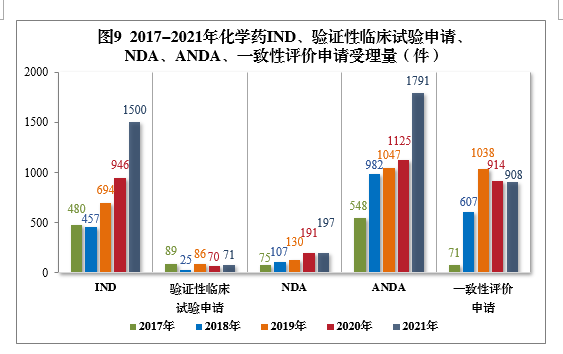
2021年需技(jì )術審評的化學(xué)藥各類别注冊申請受理(lǐ)量詳見圖8。2017-2021年化學(xué)藥IND、驗證性臨床試驗申請、NDA、ANDA、一緻性評價申請受理(lǐ)量詳見圖9。
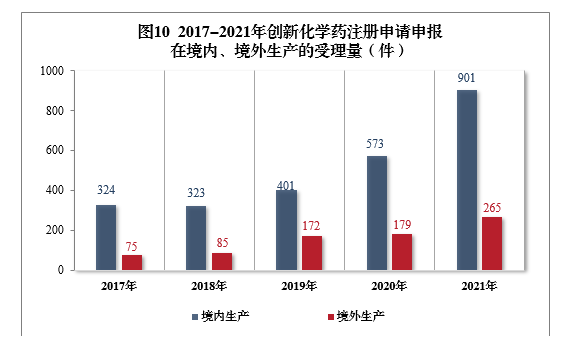
需技(jì )術審評的創新(xīn)化學(xué)藥注冊申請共1166件(508個品種)11中,以生産場地類别統計,901件(385個品種)申報在境内生産,265件(123個品種)申報在境外生産。2017-2021年創新(xīn)化學(xué)藥注冊申請申報在境内、境外生産的受理(lǐ)量詳見圖10。
(五)需技(jì )術審評的生物(wù)制品注冊申請受理(lǐ)情況
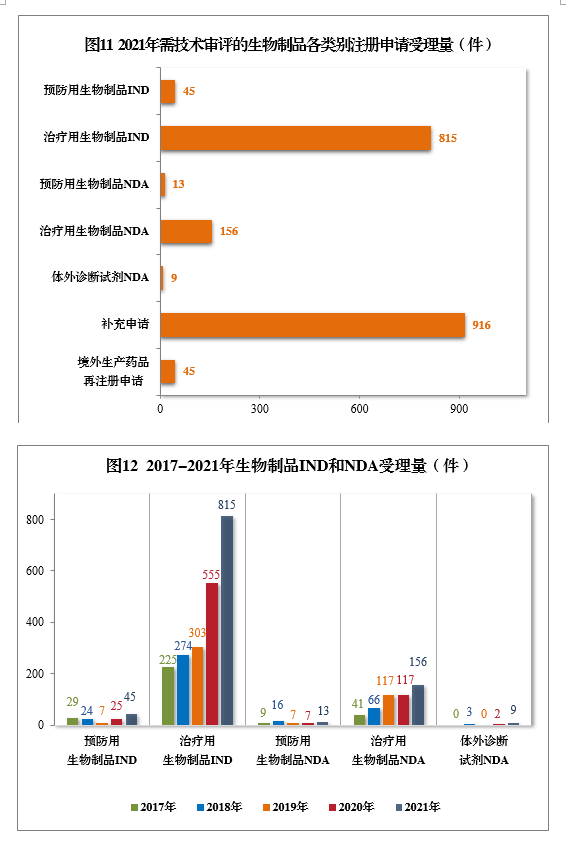
2021年受理(lǐ)需技(jì )術審評的生物(wù)制品注冊申請1999件,其中,預防用(yòng)生物(wù)制品注冊申請229件、治療用(yòng)生物(wù)制品注冊申請1755件和體(tǐ)外診斷試劑15件。以注冊申請類别統計:
IND 860件,同比增長(cháng)48.28%,包括創新(xīn)生物(wù)制品IND 643件(423個品種),同比增長(cháng)131.29%。其中,預防用(yòng)生物(wù)制品IND 45件,包括創新(xīn)預防用(yòng)生物(wù)制品IND 26件(16個品種),治療用(yòng)生物(wù)制品IND 815件,包括創新(xīn)治療用(yòng)生物(wù)制品IND 617件(407個品種)。
NDA 178件,同比增長(cháng)41.27%,包括創新(xīn)生物(wù)制品NDA 23件(16個品種),同比增長(cháng)27.78%。其中,預防用(yòng)生物(wù)制品NDA 13件,包括創新(xīn)預防用(yòng)生物(wù)制品NDA 5件(2個品種);治療用(yòng)生物(wù)制品NDA 156件,包括創新(xīn)治療用(yòng)生物(wù)制品18件(14個品種);體(tǐ)外診斷試劑9件。
補充申請916件。境外生産藥品再注冊申請45件。
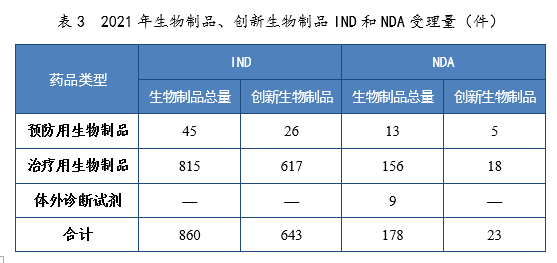
2021年生物(wù)制品、創新(xīn)生物(wù)制品IND和NDA受理(lǐ)量詳見表3。2021年需技(jì )術審評的生物(wù)制品各類别注冊申請受理(lǐ)量詳見圖11。2017-2021年生物(wù)制品IND和NDA受理(lǐ)量詳見圖12。
表3 2021年生物(wù)制品、創新(xīn)生物(wù)制品IND和NDA受理(lǐ)量(件)
需技(jì )術審評的創新(xīn)生物(wù)制品注冊申請共666件(439個品種12)中,以生産場地類别統計,境内生産創新(xīn)生物(wù)制品注冊申請530件(354個品種),境外生産創新(xīn)生物(wù)制品注冊申請136件(85個品種)。2017-2021年創新(xīn)生物(wù)制品注冊申請申報在境内、境外生産的受理(lǐ)量詳見圖13。
(六)行政審批注冊申請受理(lǐ)情況
1.總體(tǐ)情況
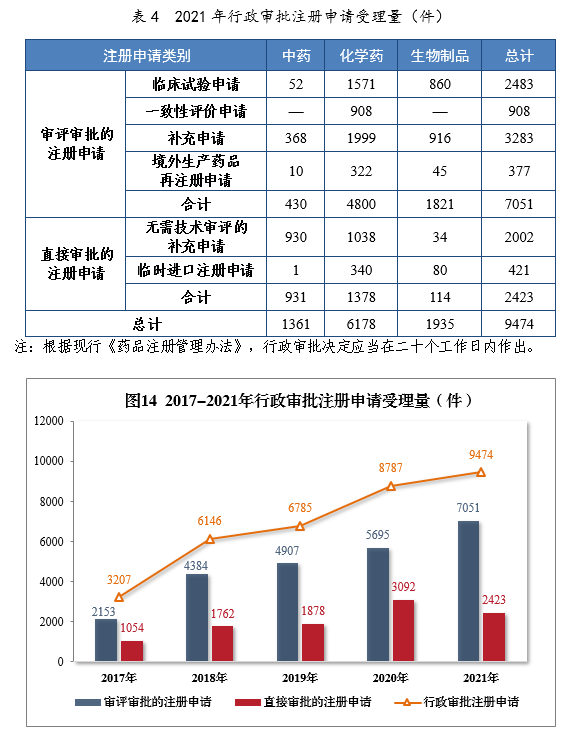
2021年受理(lǐ)行政審批注冊申請9474件,同比增長(cháng)7.82%。其中,直接審批的注冊申請2423件;審評審批的注冊申請137051件,同比增長(cháng)23.81%,包括臨床試驗申請2483件,同比增長(cháng)53.46%。
2021年行政審批注冊申請受理(lǐ)量詳見表4。201714-2021年行政審批注冊申請受理(lǐ)量詳見圖14。
2.審評審批的注冊申請受理(lǐ)情況
2021年受理(lǐ)審評審批的注冊申請7051件,以藥品類型統計,中藥注冊申請430件,同比增長(cháng)40.07%;化學(xué)藥注冊申請4800件,同比增長(cháng)17.50%,占全部審評審批的注冊申請受理(lǐ)量的68.08%;生物(wù)制品注冊申請1821件,同比增長(cháng)39.75%。
以注冊申請類别統計,臨床試驗申請2483件,同比增長(cháng)53.46%;一緻性評價申請908件;補充申請3283件,同比增長(cháng)16.13%;境外生産藥品再注冊申請377件,同比增長(cháng)14.94%。
3.直接審批的注冊申請受理(lǐ)情況
2021年受理(lǐ)直接審批的注冊申請2423件,以藥品類型統計,中藥注冊申請931件、化學(xué)藥注冊申請1378件、生物(wù)制品注冊申請114件。以注冊申請類别統計,補充申請2002件、臨時進口注冊申請421件。
第二章 藥品注冊申請審評審批情況
(一)總體(tǐ)情況
1.全年審評審批工作(zuò)情況
2021年審結的15注冊申請共12083件16,同比增長(cháng)19.55%。
審結的需技(jì )術審評的注冊申請9679件,同比增長(cháng)35.66%,包括技(jì )術審評的注冊申請2632件,審評審批的注冊申請7039件,藥械組合注冊申請8件。
審結直接審批的注冊申請2404件。2017-2021年注冊申請審結量詳見圖15。
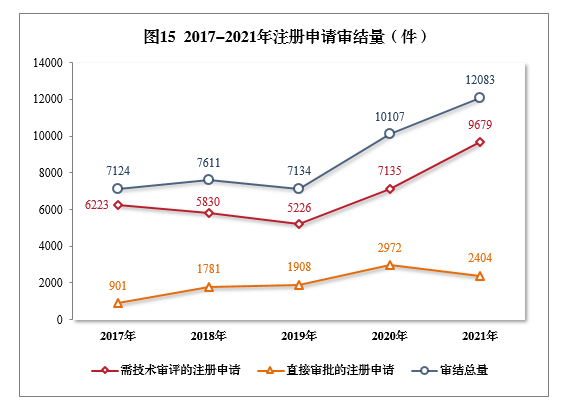
截至2021年底,有5652件注冊申請正在審評審批中;待申請人回複補充資料1353件。根據56号公告,2021年審結原料藥注冊申請494件。截至2021年底,有1302件原料藥注冊申請正在審評審批中;待申請人回複補充資料582件。
2.需技(jì )術審評的各類注冊申請審結情況
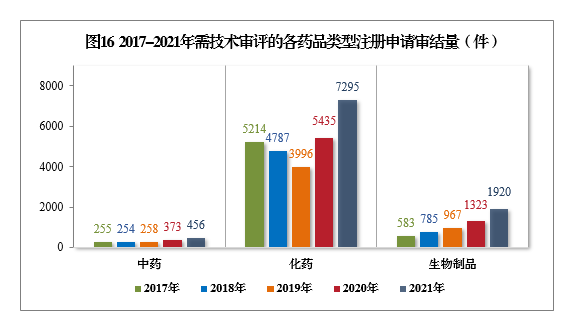
2021年審結的需技(jì )術審評的9671件17注冊申請中,以藥品類型統計,中藥注冊申請456件,同比增長(cháng)22.25%;化學(xué)藥注冊申請7295件,同比增長(cháng)34.22%,占全部需技(jì )術審評審結量的75.43%;生物(wù)制品注冊申請1920件,同比增長(cháng)45.12%。
2017-2021年需技(jì )術審評的各藥品類型注冊申請審結量詳見圖16。
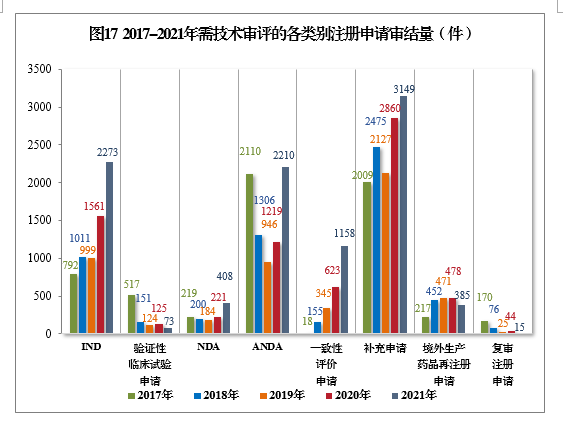
以注冊申請類别統計,IND 2273件,同比增長(cháng)45.61%;NDA 408件,同比增長(cháng)84.62%;ANDA 2210件,同比增長(cháng)81.30%;一緻性評價申請1158件,同比增長(cháng)85.87%;補充申請3149件,同比增長(cháng)10.10%。2017-2021年需技(jì )術審評的各類别注冊申請審結量詳見圖17。
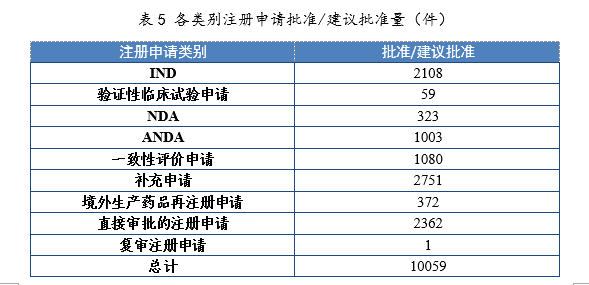
3.批準/建議批準情況
2021年批準IND 2108件,同比增長(cháng)46.90%;建議批準NDA 323件(見附件1),同比增長(cháng)55.29%;建議批準ANDA 1003件,同比增長(cháng)9.26%;批準一緻性評價申請1080件,同比增長(cháng)87.18%。各類别注冊申請批準/建議批準量詳見表5。
建議批準境外生産原研藥1876個品種(含新(xīn)增适應症品種,見附件2)。
臨床急需境外新(xīn)藥81個品種19中,截至2021年底,已有54個品種提出注冊申請,51個品種獲批上市,按審評時限審結率(以下簡稱按時限審結率)100%,臨床急需境外新(xīn)藥審評審批情況見附件3。
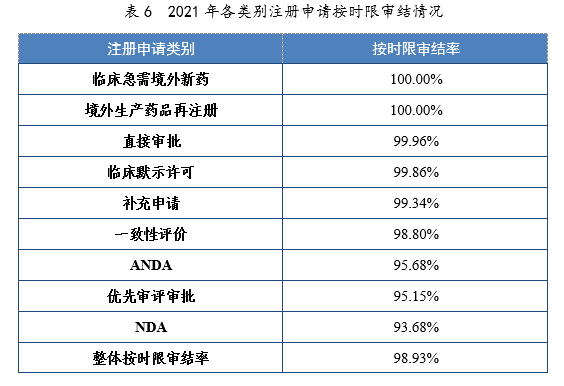
4.各類别注冊申請按時限審結情況
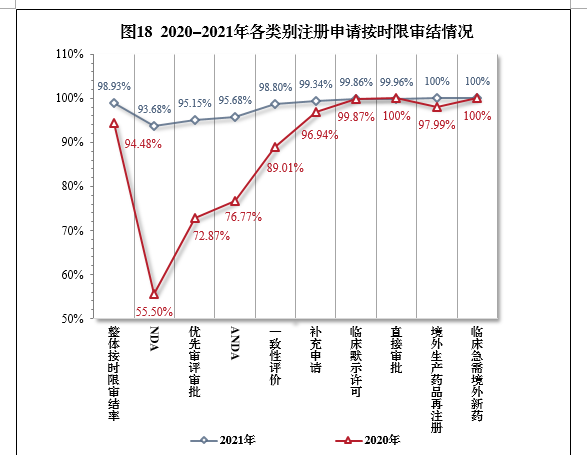
2021年,藥審中心持續優化審評流程、嚴格審評時限管理(lǐ)、加快審評速度、強化項目督導,全年整體(tǐ)按時限審結率98.93%。其中NDA、ANDA、納入優先審評審批程序的注冊申請按時限審結率均超過90%,取得曆史性突破。2021年各類别注冊申請按時限審結情況詳見表6,2020-2021年各類别注冊申請按時限審結情況詳見圖18。
(二)創新(xīn)藥注冊申請審結情況
1.總體(tǐ)情況
2021年審結創新(xīn)藥20注冊申請1744件(943個品種),同比增長(cháng)67.85%。
以藥品類型統計,創新(xīn)中藥55件(55個品種),同比增長(cháng)52.78%;創新(xīn)化學(xué)藥1085件(484個品種),同比增長(cháng)45.44%;創新(xīn)生物(wù)制品604件(404個品種),同比增長(cháng)135.02%。
以注冊申請類别統計,IND 1663件(885個品種),同比增長(cháng)67.14%;NDA 81件(58個品種),同比增長(cháng)84.09%。
2.批準/建議批準情況
2021年批準/建議批準創新(xīn)藥注冊申請1628件(878個品種),同比增長(cháng)67.32%。
以藥品類型統計,創新(xīn)中藥39件(39個品種),同比增長(cháng)39.29%;創新(xīn)化學(xué)藥1029件(463個品種),同比增長(cháng)44.32%;創新(xīn)生物(wù)制品560件(376個品種),同比增長(cháng)141.38%。以注冊申請類别統計,IND 1559件(831個品種),同比增長(cháng)65.32%,NDA 69件(47個品種,見附件4),同比增長(cháng)130.00%。
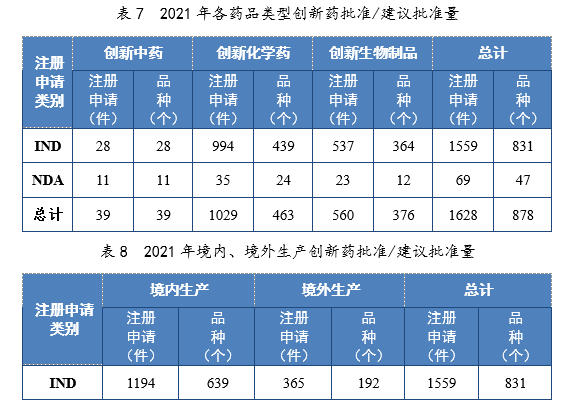
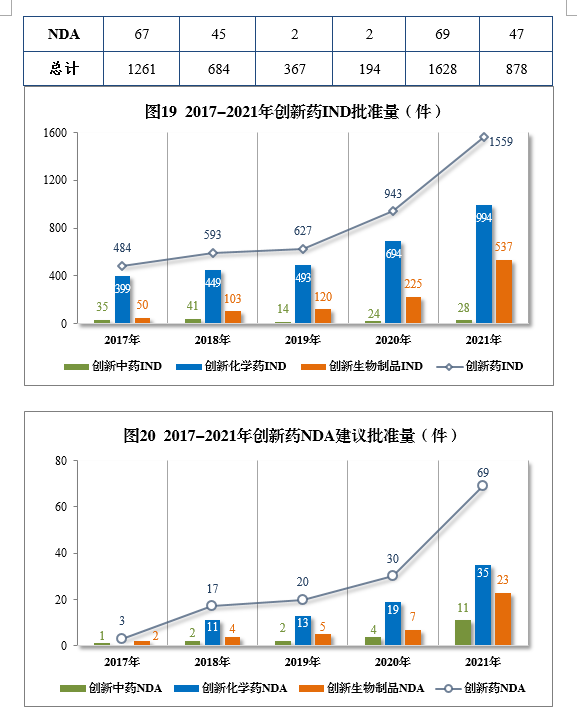
以生産場地類别統計,境内生産創新(xīn)藥1261件(684個品種),同比增長(cháng)60.84%;境外生産創新(xīn)藥367件(194個品種),同比增長(cháng)94.18%。2021年各藥品類型創新(xīn)藥批準/建議批準量詳見表7,2021年境内、境外生産創新(xīn)藥批準/建議批準量詳見表8,2017-2021年創新(xīn)藥IND批準量詳見圖19,2017-2021年創新(xīn)藥NDA建議批準量詳見圖20。
(三)需技(jì )術審評的中藥注冊申請審結情況
1.總體(tǐ)情況
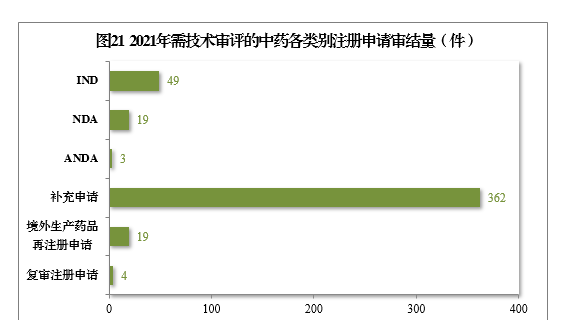
2021年審結需技(jì )術審評的中藥注冊申請456件,同比增長(cháng)22.25%。以注冊申請類别統計,IND 49件,同比增長(cháng)32.43%;NDA 19件,同比增長(cháng)216.67%;ANDA 3件。2021年需技(jì )術審評的中藥各類别注冊申請審結量詳見圖21。
2.批準/建議批準情況
2021年審結的中藥IND中,批準34件,不批準9件。審結的中藥NDA中,建議批準14件,建議不批準3件。2021年需技(jì )術審評的中藥注冊申請審結情況詳見表9。
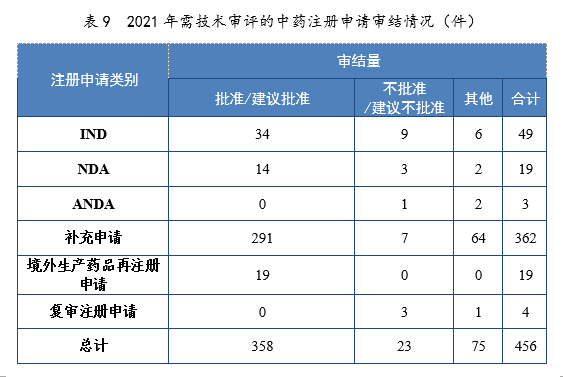
注:“其他(tā)”是指申請人未按規定繳納費用(yòng)、撤回申請等原因導緻審評審批終止的情形。
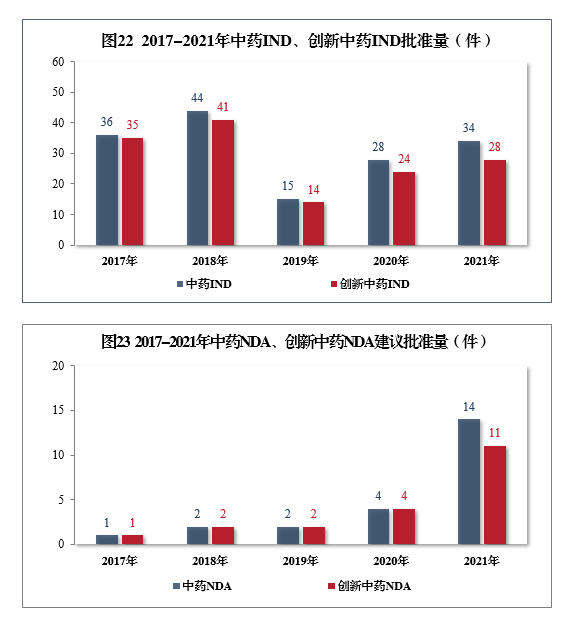
批準中藥IND 34件,同比增長(cháng)21.43%,包括創新(xīn)中藥IND 28件(28個品種),同比增長(cháng)16.67%;建議批準中藥NDA 14件,同比增長(cháng)250.00%,創5年以來新(xīn)高,包括創新(xīn)中藥NDA 11件(11個品種),同比增長(cháng)175.00%。2017-2021年中藥IND、創新(xīn)中藥IND批準量詳見圖22,2017-2021年中藥NDA、創新(xīn)中藥NDA建議批準量詳見圖23。
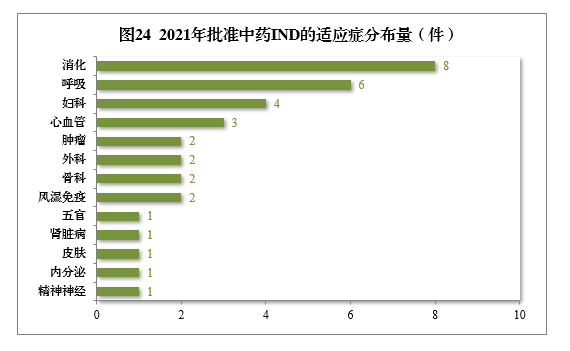
批準的34件中藥IND中,涉及13個适應症領域,其中消化8件、呼吸6件、婦科(kē)4件,共占52.94%,2021年批準中藥IND的适應症領域分(fēn)布量詳見圖24。
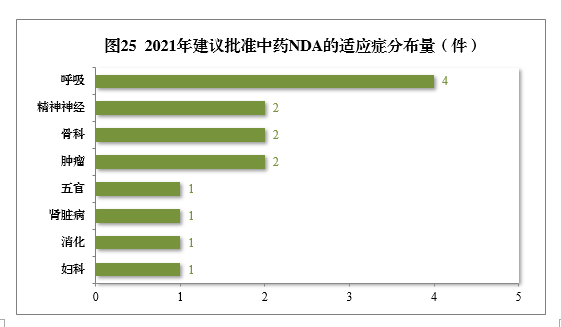
建議批準的中藥NDA 14件中,呼吸腫瘤、精(jīng)神神經、骨科(kē)藥物(wù)較多(duō),占全部中NDA批準量的71.43%。
2021年建議批準中藥NDA的适應症分(fēn)布量詳見圖25。
(四)需技(jì )術審評的化學(xué)藥注冊申請審結情況
1.總體(tǐ)情況
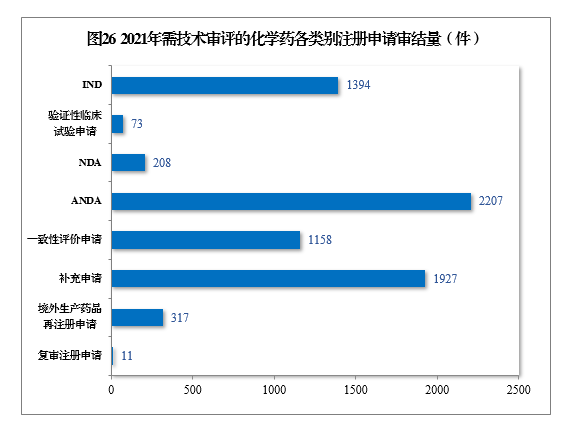
2021年審結需技(jì )術審評的化學(xué)藥注冊申請7295件。以注冊申請類别統計,化學(xué)藥臨床試驗申請1467件,同比增長(cháng)35.21%;化學(xué)藥NDA 208件,同比增長(cháng)67.74%;化學(xué)藥ANDA 2207件,同比增長(cháng)81.50%;化學(xué)藥一緻性評價申請1158件,同比增長(cháng)85.87%。2021年需技(jì )術審評的化學(xué)藥各類别注冊申請審結量詳見圖26。
2.批準/建議批準情況
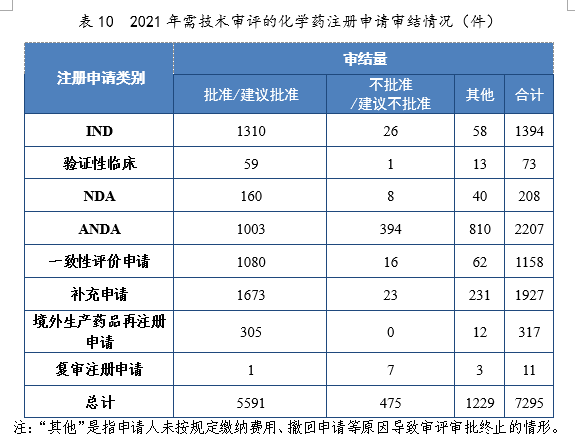
2021年審結的化學(xué)藥IND中,批準1310件,不批準26件。審結的化學(xué)藥NDA中,建議批準160件,建議不批準8件。審結的化學(xué)藥ANDA中,建議批準1003件,建議不批準394件。2021年需技(jì )術審評的化學(xué)藥注冊申請審結情況詳見表10。
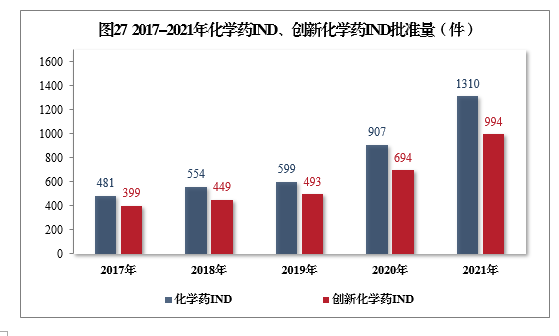
批準化學(xué)藥IND 1310件,同比增長(cháng)44.43%,其中創新(xīn)化學(xué)藥IND 994件(439個品種),同比增長(cháng)43.23%。2017-2021年化學(xué)藥IND、創新(xīn)化學(xué)藥IND批準量詳見圖27。
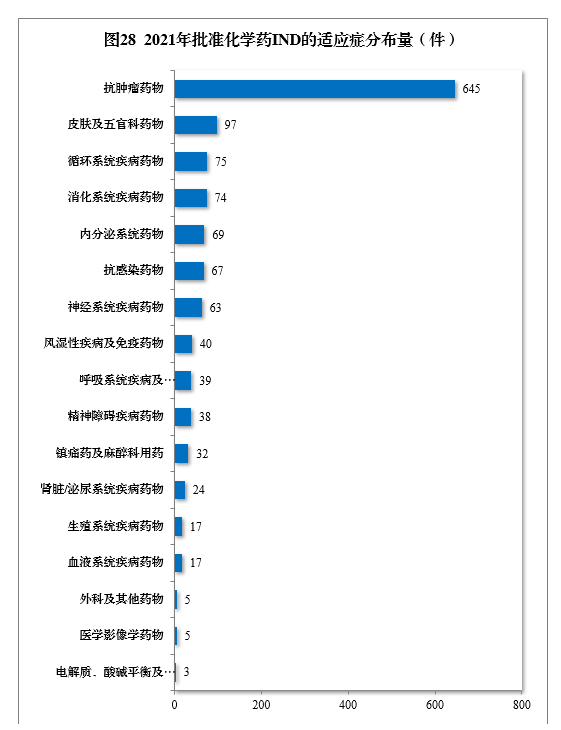
批準的化學(xué)藥IND 1310件中,抗腫瘤藥物(wù)、皮膚及五官科(kē)藥物(wù)、循環系統疾病藥物(wù)、消化系統疾病藥物(wù)、内分(fēn)泌系統藥物(wù)、抗感染藥物(wù)和神經系統疾病藥物(wù)較多(duō),占全部化學(xué)藥IND批準量的83.21%。2021年批準化學(xué)藥IND的适應症分(fēn)布量詳見圖28。
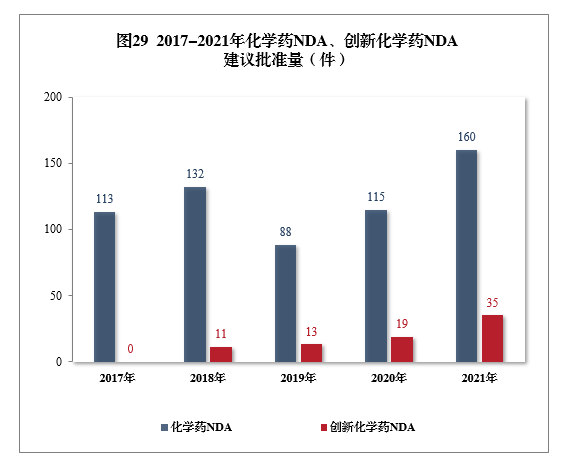
建議批準化學(xué)藥NDA 160件,同比增長(cháng)39.13%,包括創新(xīn)化學(xué)藥35件(24個品種),同比增長(cháng)84.21%;建議批準化學(xué)藥ANDA 1003件,同比增長(cháng)9.26%。2017-2021年化學(xué)藥NDA、創新(xīn)化學(xué)藥NDA建議批準量詳見圖29。
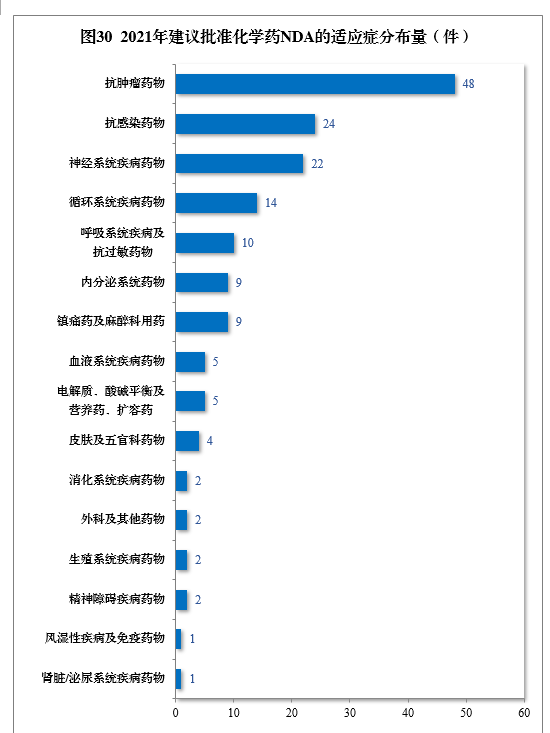
建議批準的化學(xué)藥NDA 160件中,抗腫瘤藥物(wù)、抗感染藥物(wù)、神經系統疾病藥物(wù)、循環系統疾病藥物(wù)、呼吸系統疾病及抗過敏藥物(wù)藥物(wù)較多(duō),占全部化學(xué)藥NDA批準量的73.75%。2021年建議批準化學(xué)藥NDA的适應症分(fēn)布量詳見圖30。
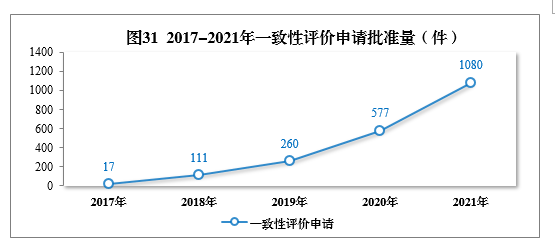
審結一緻性評價申請共1158件,批準1080件。其中口服固體(tǐ)制劑一緻性評價申請391件,注射劑一緻性評價申請689件,2017-2021年一緻性評價申請批準量詳見圖31。2021年批準的一緻性評價品種見附件5。
(五)需技(jì )術審評的生物(wù)制品注冊申請審結情況
1.總體(tǐ)情況
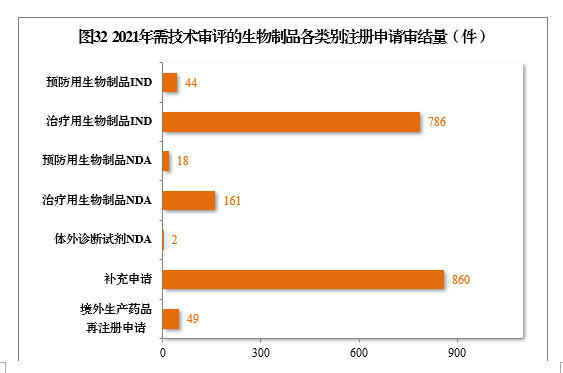
2021年,審結1920件需技(jì )術審評的生物(wù)制品注冊申請,其中,預防用(yòng)生物(wù)制品234件和治療用(yòng)生物(wù)制品1676件,體(tǐ)外診斷試劑10件。以注冊申請類别統計,IND 830件,同比增長(cháng)47.16%,NDA 181件,同比增長(cháng)98.90%,補充申請860件,境外生産藥品再注冊申請49件。2021年需技(jì )術審評的生物(wù)制品各類别注冊申請審結量詳見圖32。
2.批準/建議批準情況
2021年審結的生物(wù)制品IND中,批準764件,不批準34件。審結的生物(wù)制品NDA中,建議批準149件,建議不批準4件。2021年需技(jì )術審評的生物(wù)制品注冊申請審結情況詳見表11。
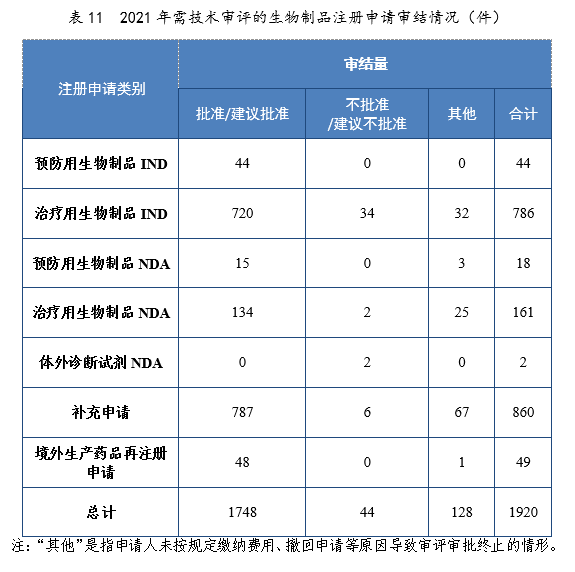
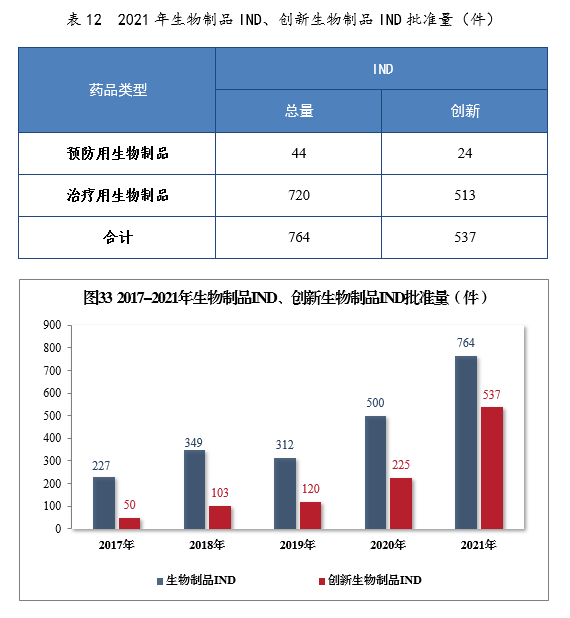
批準生物(wù)制品IND 764件,同比增長(cháng)52.80%,包括創新(xīn)生物(wù)制品IND 537件(364個品種),同比增長(cháng)138.67%。其中,預防用(yòng)生物(wù)制品IND 44件,同比增長(cháng)131.58%,包括創新(xīn)預防用(yòng)生物(wù)制品IND 24件(16個品種),同比增長(cháng)800%;治療用(yòng)生物(wù)制品IND 720件,同比增長(cháng)49.69%,包括創新(xīn)治療用(yòng)生物(wù)制品IND 513件(348個品種),同比增長(cháng)131.08%。2021年生物(wù)制品IND、創新(xīn)生物(wù)制品IND批準量詳見表12。2017-2021年生物(wù)制品IND、創新(xīn)生物(wù)制品IND批準量詳見圖33。
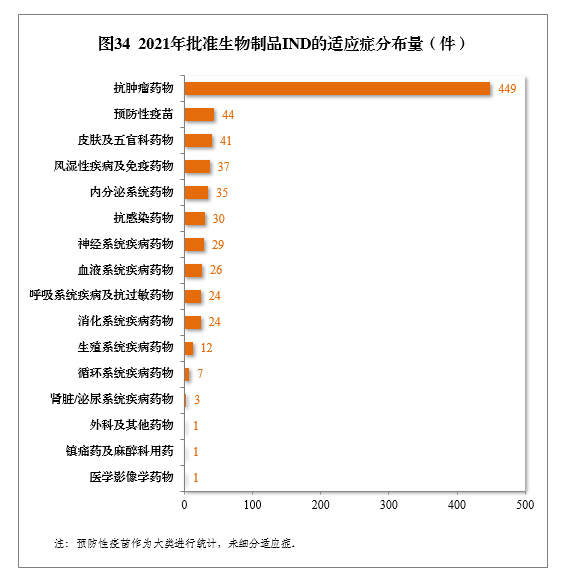
批準的生物(wù)制品IND 764件中,抗腫瘤藥物(wù)較多(duō),占全部生物(wù)制品IND批準量的58.77%。2021年批準生物(wù)制品IND的适應症分(fēn)布量詳見圖34。
建議批準生物(wù)制品NDA 149件,同比增長(cháng)67.42%,包括創新(xīn)生物(wù)制品NDA 23件(12個品種),同比增長(cháng)228.57%。其中,預防用(yòng)生物(wù)制品NDA 15件,同比增長(cháng)114.29%,包括創新(xīn)預防用(yòng)生物(wù)制品NDA 6件(3個品種);治療用(yòng)生物(wù)制品NDA 134件,同比增長(cháng)65.43%,包括創新(xīn)治療用(yòng)生物(wù)制品NDA 17件(9個品種),同比增長(cháng)142.86%。2021年生物(wù)制品NDA、創新(xīn)生物(wù)制品NDA建議批準量詳見表13。2017-2021年生物(wù)制品NDA、創新(xīn)生物(wù)制品NDA通過批準量詳見圖35。
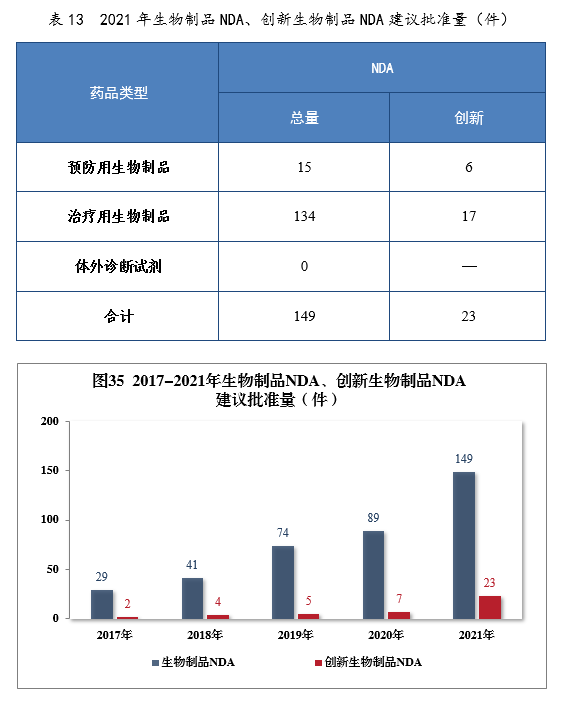
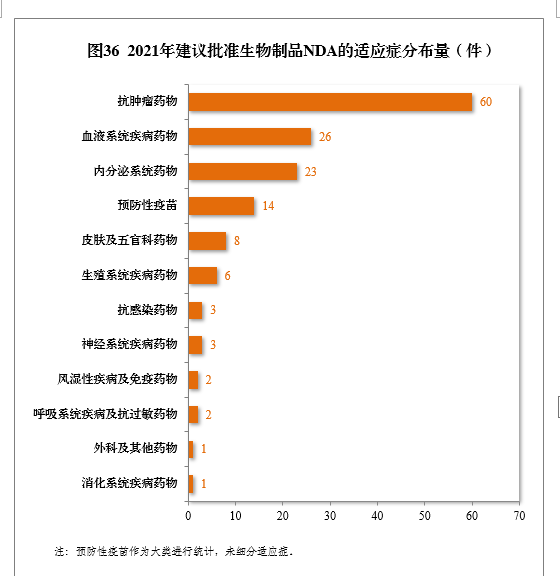
建議批準的生物(wù)制品NDA 149件中,抗腫瘤、血液系統、内分(fēn)泌系統藥物(wù)、疫苗較多(duō),占全部生物(wù)制品NDA批準量的82.55%。2021年建議批準生物(wù)制品NDA的适應症分(fēn)布量詳見圖36。
(六)行政審批注冊申請審結情況
1.總體(tǐ)情況
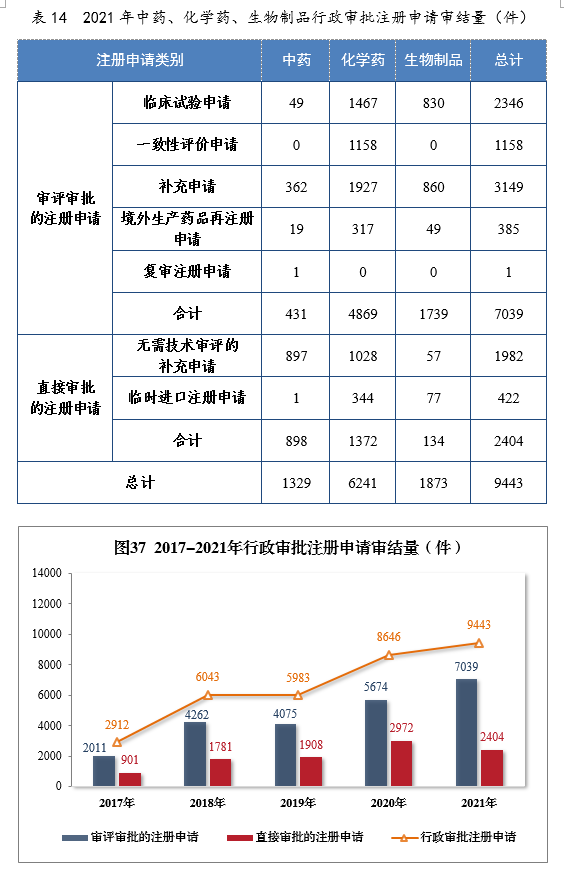
2021年審結行政審批注冊申請9443件,同比增長(cháng)9.22%。審評審批的注冊申請217039件,同比增長(cháng)24.06%;直接審批的注冊申請222404件。2021年中藥、化學(xué)藥、生物(wù)制品行政審批注冊申請審結量詳見表14。2017-2021年需行政審批注冊申請審結量詳見圖37。
2.審評審批的注冊申請審結情況
審評審批的7039件注冊申請中,以藥品類型統計,中藥注冊申請431件,同比增長(cháng)20.73%;化學(xué)藥注冊申請為(wèi)4869件,同比增長(cháng)19.16%,占全部審評審批審結量的69.17%;生物(wù)制品注冊申請1739件,同比增長(cháng)41.27%。以注冊申請類别統計,臨床試驗申請2346件,同比增長(cháng)39.15%;一緻性評價申請1158件,同比增長(cháng)85.87%;補充申請3149件,同比增長(cháng)10.10%;境外生産藥品再注冊申請385件、複審注冊申請1件。
3.直接審批的注冊申請審結情況
直接審批的2404件注冊申請中,以藥品類型統計,中藥注冊申請898件、化學(xué)藥注冊申請1372件、生物(wù)制品注冊申請134件。以注冊申請類别統計,補充申請1982件、臨時進口注冊申請422件。
(七)藥品注冊核查情況
2021年合規審查8526件注冊申請,以注冊申請類别統計,NDA 617件,ANDA 2375件,一緻性評價申請1687件,補充申請2423件,原料藥注冊申請1424件。
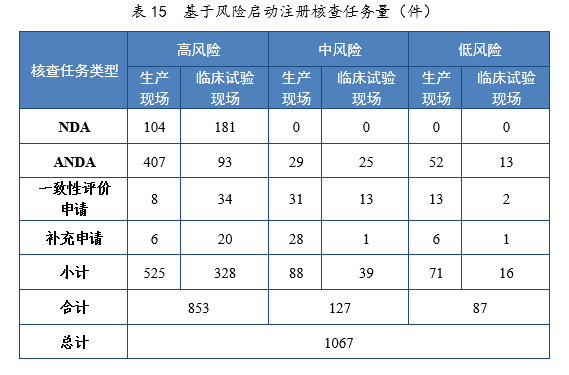
2021年基于風險共啓動注冊核查任務(wù)231067件,包括藥品注冊生産現場(以下簡稱生産現場)核查任務(wù)684件,藥物(wù)臨床試驗現場(以下簡稱臨床試驗現場)核查任務(wù)383件;以注冊申請類别統計,NDA核查任務(wù)285件,ANDA核查任務(wù)619件,一緻性評價申請核查任務(wù)101件,補充申請核查任務(wù)62件。基于風險啓動注冊核查任務(wù)量詳見表15。
此外,啓動了新(xīn)冠病毒治療藥物(wù)、新(xīn)冠病毒疫苗的現場核查、有因檢查34次。
2021年國(guó)家藥品監督管理(lǐ)局食品藥品審核查驗中心共返回藥審中心各類核查報告1165件。
第三章 藥品加快上市注冊程序和溝通交流情況
(一)藥品加快上市注冊程序情況
1.突破性治療藥物(wù)程序
2021年受理(lǐ)的注冊申請中,申請适用(yòng)突破性治療藥物(wù)程序的注冊申請263件。經綜合評估、公示,53件(41個品種)納入突破性治療藥物(wù)程序,覆蓋了新(xīn)型冠狀病毒感染引起的疾病、非小(xiǎo)細胞肺癌、卵巢癌等适應症。2021年藥審中心突破性治療藥物(wù)程序納入情況詳見附件6。2021年建議批準的NDA中,有5件被納入了突破性治療藥物(wù)程序得以加快上市。
2.附條件批準程序
2021年建議批準的323件NDA中,共有60件(38個品種)經附條件批準後上市,占比18.58%。2021年新(xīn)藥上市許可(kě)的附條件批準情況詳見附件1。
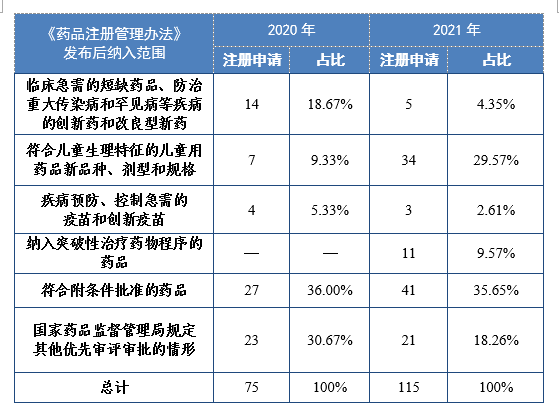
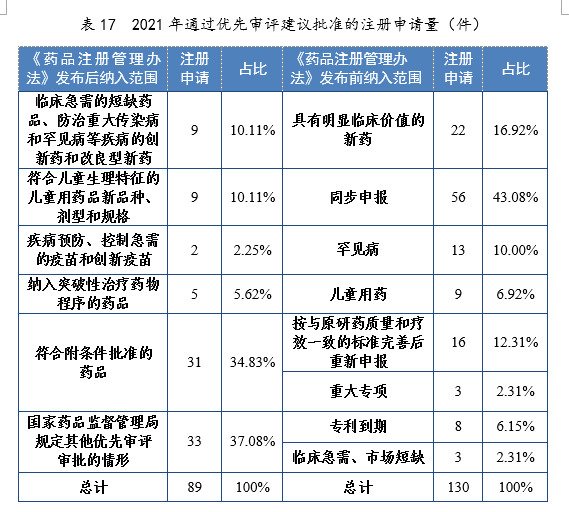
3.優先審評審批程序
根據現行《藥品注冊管理(lǐ)辦法》,2021年共115件注冊申請(69個品種)納入優先審評審批程序。其中,符合附條件批準的藥品41件,占比35.65%,符合兒童生理(lǐ)特征的兒童用(yòng)藥品新(xīn)品種、劑型和規格34件,占比29.57%。藥審中心優先審評資源逐年加大向具有臨床優勢的新(xīn)藥、兒童用(yòng)藥、罕見病藥物(wù)注冊申請傾斜。
2020-2021年根據現行《藥品注冊管理(lǐ)辦法》納入優先審評審批程序的注冊申請量詳見表16。
表16 2020-2021年根據現行《藥品注冊管理(lǐ)辦法》納入優先審評審批程序的注冊申請量(件)
4.特别審批程序
2021年審結81件納入特别審批程序的注冊申請(新(xīn)冠病毒疫苗和治療藥物(wù)),其中,批準新(xīn)冠病毒疫苗IND 12件,建議批準新(xīn)冠病毒疫苗NDA 5件(均為(wèi)附條件批準上市),分(fēn)别為(wèi)4件新(xīn)型冠狀病毒滅活疫苗(Vero細胞)、1件重組新(xīn)型冠狀病毒疫苗(5型腺病毒載體(tǐ));批準新(xīn)冠病毒治療藥物(wù)IND 15件,分(fēn)别為(wèi)小(xiǎo)分(fēn)子抗病毒藥物(wù)4件,中和抗體(tǐ)9件,其他(tā)類藥物(wù)2件;建議批準新(xīn)冠病毒治療藥物(wù)NDA 5件,分(fēn)别為(wèi)清肺排毒顆粒、化濕敗毒顆粒、宣肺敗毒顆粒、新(xīn)冠病毒中和抗體(tǐ)聯合治療藥物(wù)安(ān)巴韋單抗注射液(BRII-196)及羅米司韋單抗注射液(BRII-198);批準涉及新(xīn)冠病毒相關補充申請44件。
(二)與申請人溝通交流情況
藥審中心不斷調整溝通交流和咨詢方式,以适應疫情防控常态化和申請人逐年增長(cháng)的溝通交流需求。目前,藥審中心與申請人溝通交流和咨詢的方式主要有:召開溝通交流會議、藥審中心網站(申請人之窗)一般性技(jì )術問題咨詢、電(diàn)話咨詢、郵件咨詢等。
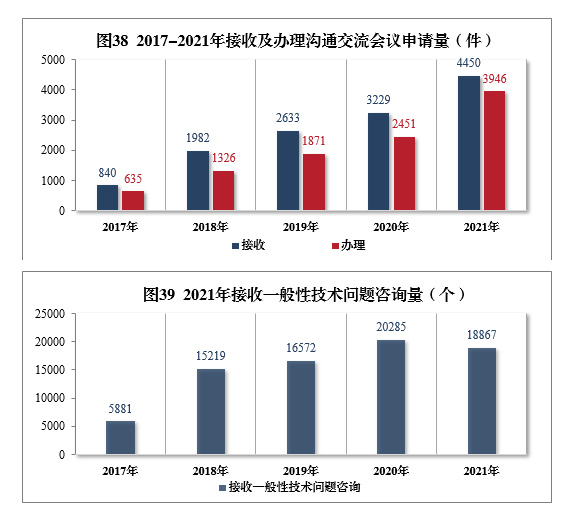
2021年接收溝通交流會議申請4450件,同比增長(cháng)37.81%,辦理(lǐ)溝通交流會議申請3946件,同比增長(cháng)61.00%。接收一般性技(jì )術問題咨詢18867個,辦理(lǐ)一般性技(jì )術問題咨詢18423個;辦理(lǐ)電(diàn)話咨詢一萬餘次,8個聯系郵箱24咨詢近萬次,2017-2021年接收及辦理(lǐ)溝通交流會議申請量詳見圖38,2021年接收一般性技(jì )術問題咨詢量詳見圖39。
2.溝通交流會議辦理(lǐ)情況
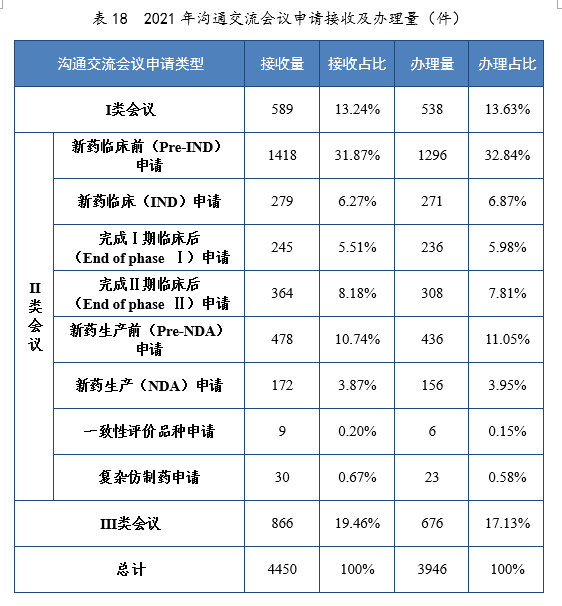
2021年接收溝通交流會議申請4450件。經綜合評估,符合溝通交流會議召開條件的,及時與申請人取得聯系,商議會議細節;無需召開溝通交流會議的,以書面形式盡快回複申請人。2021年辦理(lǐ)溝通交流會議申請3946件,在藥物(wù)研發關鍵階段召開的Ⅱ類會議69.23%,其中新(xīn)藥臨床前(Pre-IND)申請32.84%,新(xīn)藥生産前(Pre-NDA)申請11.05%。2021年溝通交流會議申請接收及辦理(lǐ)量詳見表18。
2021年召開溝通交流會議(面對面會議、視頻會議和電(diàn)話會議)425次,同比增長(cháng)58.58%。Ⅱ類會議占比70.35%,其中新(xīn)藥臨床前(Pre-IND)申請占比21.65%;新(xīn)藥生産前(Pre-IND)申請占比18.12%。2018-2021年溝通交流會議召開量詳見表19。
第四章 藥品注冊申請存在的主要問題及分(fēn)析
2021年,藥品注冊申請經技(jì )術審評後審評結論為(wèi)不批準/建議不批準的注冊申請542件,其中,359件屬于因申請人未能(néng)在規定時限内補充資料的情形,占全年不批準/建議不批準總量的66.3%,包括中藥9件、化學(xué)藥349件、生物(wù)制品1件;183件注冊申請主要存在申報資料無法證明申請注冊藥品的安(ān)全性、有效性或質(zhì)量可(kě)控性等缺陷問題,包括中藥14件、化學(xué)藥126件、生物(wù)制品43件。
(一)主要問題
1.研發立題方面
這方面問題主要存在于早期開發品種(IND階段)和某些仿制藥及補充申請的開發立項階段。具體(tǐ)包括:藥物(wù)研發的臨床定位不清,适應症選擇不合理(lǐ);劑型或給藥途徑選擇不合理(lǐ);已有研究數據提示藥效作(zuò)用(yòng)不明顯,作(zuò)用(yòng)靶點和機制不清晰,成藥性風險高;聯合用(yòng)藥違背臨床診療和用(yòng)藥原則,或缺乏有效性和安(ān)全性研究數據支持;已有的研究數據不支持已上市品種的改良開發;仿制藥研發的參比制劑因安(ān)全有效性問題已撤市;補充申請變更事項缺乏科(kē)學(xué)性和合理(lǐ)性。
2.有效性方面
這方面問題在上市注冊申請中比較常見。具體(tǐ)包括:已有的臨床研究數據尚無法證明品種的有效性;已開展的臨床研究存在試驗方案或者研究質(zhì)量控制問題,無法評價受試品種的有效性;仿制藥人體(tǐ)生物(wù)等效性試驗結果表明和參比制劑不等效;化學(xué)藥注冊分(fēn)類第3類的上市注冊申請缺乏境内有效性臨床數據。
3.安(ān)全性方面
藥物(wù)安(ān)全性方面問題存在于藥物(wù)開發的各個階段。具體(tǐ)包括:早期(IND階段)研究結果提示毒性明顯或者安(ān)全窗過于狹窄,難以進入臨床開發或提示應用(yòng)于臨床可(kě)能(néng)綜合獲益非常有限;臨床前安(ān)全性研究方法或研究質(zhì)量控制問題,或者研究數據不充分(fēn),不足以支持後續臨床開發;已有的臨床研究數據顯示存在嚴重不良反應,臨床應用(yòng)獲益和風險比值不合理(lǐ);化學(xué)藥注冊分(fēn)類第3類的上市注冊申請缺乏境内安(ān)全性臨床數據。
4.質(zhì)量可(kě)控性方面
這方面問題常見于仿制藥的開發。具體(tǐ)包括:藥學(xué)研究存在嚴重缺陷,無法證明産品的質(zhì)量可(kě)控性;申報資料無法證明仿制藥與參比制劑質(zhì)量的一緻性;各開發階段的研究受試樣品不一緻;樣品穩定性研究結果、原料藥起始物(wù)料選擇等不符合仿制藥上市技(jì )術要求;仿制藥未按規定使用(yòng)具有合法來源的原料藥;樣品複核檢驗不符合規定或檢驗方法存在嚴重缺陷。
5.合規性方面
這方面問題常見于經注冊核查和注冊檢驗的注冊申請。具體(tǐ)包括:注冊核查中發現研究數據存在真實性問題;注冊核查中發現其他(tā)影響産品質(zhì)量的重大缺陷;注冊核查抽樣檢驗不合格。
6.其他(tā)方面
具體(tǐ)包括:未按溝通交流時監管方提出的要求和标準提供研究數據或補充完善研究項目;審評中發現研究内容缺項,無法支持注冊申請事項;藥品說明書修訂補充申請不符合說明書撰寫要求和管理(lǐ)規範;用(yòng)于支持變更補充申請的文(wén)獻依據或者研究數據支持不足。
(二)與往年情況的比較
總體(tǐ)上看,2021年注冊申請存在的主要問題,在分(fēn)類、具體(tǐ)表現等方面與往年具有較大的相似性。但也出現了一些變化,主要包括:
1.出現的新(xīn)問題
申請人未按在臨床試驗申請前溝通交流時監管方提出的補充資料要求提交研究資料,導緻審評過程中發現IND研究内容缺項。根據現行《藥品注冊管理(lǐ)辦法》第八十八條規定,申請人在藥物(wù)臨床試驗申請的審評期間不得補充新(xīn)的技(jì )術資料,緻使審評不通過。
上述情況主要由于申請人未注意依據現行《藥品注冊管理(lǐ)辦法》在審評期間不得補充新(xīn)的技(jì )術資料,在提交注冊申請資料時忽視了溝通交流中已明确的應提交的研究資料。此類情形是過往導緻無法獲批的原因中很(hěn)少見到的。
2.基于某些問題而不批準的品種數量發生變化
一是2021年沒有出現因未進行溝通交流而不批準的注冊申請;二是因缺乏境内有效性、安(ān)全性臨床數據而未獲批準的化學(xué)藥注冊分(fēn)類第3類上市注冊申請數量較往年明顯增加;三是因合規性問題而未獲批準的注冊申請數量較往年有減少趨勢;四是開發立題合理(lǐ)性問題未獲批準的注冊申請數量增加趨勢明顯。
上述情況和注冊申請過程中溝通交流管理(lǐ)要求,以及現行《藥品注冊管理(lǐ)辦法》實施後化學(xué)藥注冊分(fēn)類第3類上市注冊申請審評結論管理(lǐ)要求的調整有關。
(三)啓示和建議
對近期注冊申請存在的主要問題進行梳理(lǐ)分(fēn)析,可(kě)以從中得到啓示,并為(wèi)參與藥物(wù)研發、注冊、監管的各方提供參考建議。
1.充分(fēn)重視藥物(wù)開發立題依據
藥物(wù)開發應立足于臨床需求,尤其應重視解決未被滿足的臨床需求問題;應以臨床價值為(wèi)導向,充分(fēn)重視同類創新(xīn)藥開發的優勢問題,避免群體(tǐ)化、低水平、重複性創新(xīn);應充分(fēn)評估改良型新(xīn)藥的臨床價值和優勢;變更補充申請應遵循必要性與合理(lǐ)性原則等。
2.利用(yòng)好溝通交流機制
在已有的溝通交流機制下,申請人除了在藥物(wù)開發過程的各關鍵節點提出溝通交流申請,還可(kě)以加強在研發其他(tā)環節和審評審批過程中的溝通交流;溝通交流應基于問題,解決問題,就關注的問題達成共識,消除信息不對等,不宜将溝通交流和行政審批程序等同起來;對于溝通交流達成的共識,各方應予以充分(fēn)遵循。
3.加強創新(xīn)藥物(wù)開發的前期基礎研究
某些新(xīn)機制、新(xīn)靶點宜做充分(fēn)的成藥性評估,開展盡可(kě)能(néng)多(duō)的概念驗證研究,以降低後續開發風險,以免造成研究資源浪費;創新(xīn)藥商業開發策略應建立在科(kē)學(xué)性基礎上,重視成藥性證據鏈的完整性;應遵循藥物(wù)開發的科(kē)學(xué)邏輯,循序漸進,盡量減少非科(kē)學(xué)因素對開發進程的幹擾。
第五章 重點治療領域品種
新(xīn)冠病毒疫苗和新(xīn)冠肺炎治療藥物(wù):
1-2.新(xīn)型冠狀病毒滅活疫苗(Vero細胞)(北京科(kē)興中維生物(wù)技(jì )術有限公司)、新(xīn)型冠狀病毒滅活疫苗(Vero細胞)(國(guó)藥集團中國(guó)生物(wù)武漢生物(wù)制品研究所有限責任公司),适用(yòng)于預防新(xīn)型冠狀病毒感染所緻的疾病(COVID-19)。
3.重組新(xīn)型冠狀病毒疫苗(5型腺病毒載體(tǐ)),為(wèi)首家獲批的國(guó)産腺病毒載體(tǐ)新(xīn)冠病毒疫苗,适用(yòng)于預防由新(xīn)型冠狀病毒感染引起的疾病(COVID-19)。
4-6.清肺排毒顆粒、化濕敗毒顆粒、宣肺敗毒顆粒,即“三方”品種,為(wèi)《新(xīn)型冠狀病毒肺炎診療方案(試行第九版)》推薦藥物(wù),清肺排毒顆粒用(yòng)于感受寒濕疫毒所緻的疫病,化濕敗毒顆粒用(yòng)于濕毒侵肺所緻的疫病,宣肺敗毒顆粒用(yòng)于濕毒郁肺所緻的疫病。“三方”品種均來源于古代經典名方,是新(xīn)冠肺炎疫情暴發以來,在武漢抗疫臨床一線(xiàn)衆多(duō)院士專家篩選出有效方藥清肺排毒湯、化濕敗毒方、宣肺敗毒方的成果轉化,也是《國(guó)家藥監局關于發布〈中藥注冊分(fēn)類及申報資料要求〉的通告》(2020年第68号)後首次按照“中藥注冊分(fēn)類 3.2類 其他(tā)來源于古代經典名方的中藥複方制劑”審評審批的品種。“三方”品種的獲批上市為(wèi)新(xīn)冠肺炎治療提供了更多(duō)選擇,充分(fēn)發揮了中醫(yī)藥在疫情防控中的作(zuò)用(yòng)。
7-8.安(ān)巴韋單抗注射液(BRII-196)、羅米司韋單抗注射液(BRII-198),為(wèi)我國(guó)首家獲批擁有自主知識産權新(xīn)冠病毒中和抗體(tǐ)聯合治療藥物(wù),上述兩個藥品可(kě)治療新(xīn)型冠狀病毒肺炎(COVID-19),聯合用(yòng)于治療輕型和普通型且伴有進展為(wèi)重型(包括住院或死亡)高風險因素的成人和青少年(12—17歲,體(tǐ)重≥40kg)新(xīn)型冠狀病毒感染(COVID-19)患者,其中,青少年(12—17歲,體(tǐ)重≥40kg)适應症人群為(wèi)附條件批準,其獲批上市為(wèi)新(xīn)冠肺炎治療提供了更多(duō)選擇。
中藥新(xīn)藥:
9.益氣通竅丸,具有益氣固表,散風通竅的功效,适用(yòng)于治療對季節性過敏性鼻炎中醫(yī)辨證屬肺脾氣虛證。本品為(wèi)黃芪、防風等14種藥味組成的原6類中藥新(xīn)藥複方制劑,在中醫(yī)臨床經驗方基礎上進行研制,開展了随機、雙盲、安(ān)慰劑平行對照、多(duō)中心臨床試驗,其獲批上市為(wèi)季節性過敏性鼻炎患者提供了一種新(xīn)的治療選擇。
10.益腎養心安(ān)神片,功能(néng)主治為(wèi)益腎、養心、安(ān)神,适用(yòng)于治療失眠症中醫(yī)辨證屬心血虧虛、腎精(jīng)不足證,症見失眠、多(duō)夢、心悸、神疲乏力、健忘、頭暈、腰膝酸軟等,舌淡紅苔薄白,脈沉細或細弱。本品為(wèi)炒酸棗仁、制何首烏等10種藥味組成的原6類中藥新(xīn)藥複方制劑,在中醫(yī)臨床經驗方基礎上進行研制,開展了随機、雙盲、安(ān)慰劑平行對照、多(duō)中心臨床試驗,其獲批上市為(wèi)失眠症患者提供了一種新(xīn)的治療選擇。
11.銀翹清熱片,功能(néng)主治為(wèi)辛涼解表,清熱解毒,适用(yòng)于治療外感風熱型普通感冒,症見發熱、咽痛、惡風、鼻塞、流涕、頭痛、全身酸痛、汗出、咳嗽、口幹,舌紅、脈數。本品為(wèi)金銀花(huā)、葛根等9種藥味組成的1.1類中藥創新(xīn)藥,在中醫(yī)臨床經驗方基礎上進行研制,開展了多(duō)中心、随機、雙盲、安(ān)慰劑/陽性藥平行對照臨床試驗,其獲批上市為(wèi)外感風熱型普通感冒患者提供了一種新(xīn)的治療選擇。
12.玄七健骨片,具有活血舒筋,通脈止痛,補腎健骨的功效,适用(yòng)于治療輕中度膝骨關節炎中醫(yī)辨證屬筋脈瘀滞證的症狀改善。本品為(wèi)延胡索、全蠍等11種藥味組成的1.1類中藥創新(xīn)藥,基于中醫(yī)臨床經驗方基礎上進行研制,通過開展随機、雙盲、安(ān)慰劑平行對照、多(duō)中心臨床試驗,獲得安(ān)全性、有效性證據,其獲批上市将為(wèi)患者提供一種新(xīn)的治療選擇。
13.芪蛭益腎膠囊,具有益氣養陰,化瘀通絡的功效,适用(yòng)于治療早期糖尿病腎病氣陰兩虛證。本品為(wèi)黃芪、地黃等10種藥味組成的1.1類中藥創新(xīn)藥,基于中醫(yī)臨床經驗方基礎上進行研制,通過開展随機、雙盲、安(ān)慰劑平行對照、多(duō)中心臨床試驗,獲得安(ān)全性、有效性證據,其獲批上市将為(wèi)患者提供新(xīn)的治療選擇。
14.坤心甯顆粒,具有溫陽養陰,益腎平肝的功效,适用(yòng)于治療女性更年期綜合征中醫(yī)辨證屬腎陰陽兩虛證。本品為(wèi)地黃、石決明等7種藥味組成的1.1類中藥創新(xīn)藥,基于中醫(yī)臨床經驗方基礎上進行研制,通過開展随機、雙盲、安(ān)慰劑平行對照、多(duō)中心臨床試驗,獲得安(ān)全性、有效性證據,其獲批上市将為(wèi)患者提供新(xīn)的治療選擇。
15.虎貞清風膠囊,具有清熱利濕,化瘀利濁,滋補肝腎的功效,适用(yòng)于治療輕中度急性痛風性關節炎中醫(yī)辨證屬濕熱蘊結證。本品為(wèi)虎杖、車(chē)前草(cǎo)等4種藥味組成的1.1類中藥創新(xīn)藥,在中醫(yī)臨床經驗方基礎上進行研制,開展了随機、雙盲、安(ān)慰劑平行對照、多(duō)中心臨床試驗,獲得安(ān)全性、有效性證據,其獲批上市将為(wèi)患者提供新(xīn)的治療選擇。
16.解郁除煩膠囊,具有解郁化痰、清熱除煩的功效,适用(yòng)于治療輕、中度抑郁症中醫(yī)辨證屬氣郁痰阻、郁火内擾證。本品種為(wèi)栀子、姜厚樸等8種藥味組成的1.1類中藥創新(xīn)藥,在中醫(yī)臨床經驗方基礎上進行研制,處方根據中醫(yī)經典著作(zuò)《金匮要略》記載的半夏厚樸湯和《傷寒論》記載的栀子厚樸湯化裁而來,開展了随機、雙盲、陽性對照藥(化學(xué)藥品)、安(ān)慰劑平行對照、多(duō)中心臨床試驗,獲得安(ān)全性、有效性證據,其獲批上市将為(wèi)患者提供新(xīn)的治療選擇。
17.七蕊胃舒膠囊,具有活血化瘀,燥濕止痛的功效,适用(yòng)于治療輕中度慢性非萎縮性胃炎伴糜爛濕熱瘀阻證所緻的胃脘疼痛。本品為(wèi)三七、枯礬等4種藥味組成的1.1類中藥創新(xīn)藥,在醫(yī)療機構制劑基礎上進行研制,開展了随機、雙盲、陽性藥平行對照、多(duō)中心臨床試驗,其獲批上市為(wèi)慢性胃炎患者提供了新(xīn)的治療選擇。
18.淫羊藿素軟膠囊,适用(yòng)于治療不适合或患者拒絕接受标準治療、且既往未接受過全身系統性治療的、不可(kě)切除的肝細胞癌,患者外周血複合标志(zhì)物(wù)滿足以下檢測指标的至少兩項:AFP≥400 ng/mL;TNF-α<2.5pg/mL;IFN-γ≥7.0pg/mL。本品為(wèi)從中藥材淫羊藿中提取制成的1.2類中藥創新(xīn)藥,其獲批上市為(wèi)肝細胞癌患者提供了新(xīn)的治療選擇。
罕見病藥物(wù):
19.布羅索尤單抗注射液,适用(yòng)于治療成人和1歲以上兒童患者的X連鎖低磷血症(XLH)。X連鎖低磷血症屬罕見病,目前尚無有效治療藥物(wù)。本品種屬臨床急需境外新(xīn)藥名單品種,為(wèi)以成纖維細胞生長(cháng)因子23(FGF23)抗原為(wèi)靶點的一種重組全人源IgG1單克隆抗體(tǐ),可(kě)結合并抑制FGF23活性從而使血清磷水平增加,其獲批上市為(wèi)患者提供了新(xīn)的治療選擇。
20.醋酸艾替班特注射液,适用(yòng)于治療成人、青少年和≥2歲兒童的遺傳性血管性水腫急性發作(zuò)。遺傳性血管性水腫屬罕見病,近半數患者會出現上呼吸道黏膜水腫,引發窒息進而危及生命,已被納入國(guó)家衛生健康委員會等五部門聯合公布的《第一批罕見病目錄》。本品種屬臨床急需境外新(xīn)藥名單品種,為(wèi)緩激肽B2受體(tǐ)的競争性拮抗劑,其獲批上市可(kě)為(wèi)我國(guó)遺傳性血管性水腫患者的預防發作(zuò)提供安(ān)全有效的藥物(wù)。
21.注射用(yòng)艾諾凝血素α,适用(yòng)于成人和兒童B型血友病(先天性IX因子缺乏)患者的以下治療:按需治療以及控制出血事件;圍手術期的出血管理(lǐ);常規預防,以降低出血事件的發生頻率。血友病B屬遺傳性、出血性罕見病,目前國(guó)内尚無長(cháng)效重組人凝血因子Ⅸ進口或上市。本品種屬臨床急需境外新(xīn)藥名單品種,為(wèi)首個在國(guó)内申報進口的長(cháng)效重組人凝血因子IX産品,其獲批上市為(wèi)患者提供了新(xīn)的治療選擇。
22.注射用(yòng)司妥昔單抗,适用(yòng)于治療人體(tǐ)免疫缺陷病毒(HIV)陰性和人疱疹病毒8型(HHV-8)陰性的多(duō)中心卡斯特曼病(MCD)成人患者。MCD是一種以淋巴組織生長(cháng)為(wèi)特征的罕見病,多(duō)數患者出現多(duō)器官損害且預後差,部分(fēn)患者會轉化為(wèi)惡性淋巴瘤,已被納入國(guó)家衛生健康委員會等五部門聯合公布的《第一批罕見病目錄》。本品種屬臨床急需境外新(xīn)藥名單品種,其獲批上市為(wèi)患者提供了治療選擇。
23.奧法妥木(mù)單抗注射液,适用(yòng)于治療成人複發型多(duō)發性硬化(RMS),包括臨床孤立綜合征、複發緩解型多(duō)發性硬化和活動性繼發進展型多(duō)發性硬化。多(duō)發性硬化(MS)是免疫介導的慢性中樞神經系統疾病,已被納入國(guó)家衛生健康委員會等五部門聯合公布的《第一批罕見病目錄》。本品為(wèi)抗人CD20的全人源免疫球蛋白G1單克隆抗體(tǐ),其獲批上市為(wèi)患者提供了治療選擇。
兒童用(yòng)藥:
24.利司撲蘭口服溶液用(yòng)散,适用(yòng)于治療2月齡及以上患者的脊髓性肌萎縮症(SMA)。SAM是由于運動神經元存活基因1(SMN1)突變導緻SMN蛋白功能(néng)缺陷所緻的遺傳性神經肌肉病,是造成嬰幼兒死亡的常染色體(tǐ)隐性遺傳疾病之一,已被納入國(guó)家衛生健康委員會等五部門聯合公布的《第一批罕見病目錄》。本品種為(wèi)治療兒童罕見病的1類創新(xīn)藥,可(kě)直接靶向疾病的潛在分(fēn)子缺陷,增加中樞組織和外周組織的功能(néng)性SMN蛋白的産生,其獲批上市可(kě)為(wèi)SMA患者提供新(xīn)的治療選擇。
25.達妥昔單抗β注射液,适用(yòng)于治療≥12月齡的高危神經母細胞瘤和伴或不伴有殘留病竈的複發性或難治性神經母細胞瘤的兒童患者。神經母細胞瘤為(wèi)兒童常見的惡性腫瘤之一,尚無免疫治療産品獲批上市。本品種屬臨床急需境外新(xīn)藥名單品種,其獲批上市可(kě)豐富兒童患者的治療選擇。
26.順鉑注射液,此前已批準适用(yòng)于小(xiǎo)細胞與非小(xiǎo)細胞肺癌、非精(jīng)原細胞性生殖細胞癌、晚期難治性卵巢癌、晚期難治性膀胱癌、難治性頭頸鱗狀細胞癌、胃癌、食管癌的姑息治療,此次新(xīn)增批準了兒童用(yòng)法用(yòng)量,其獲批上市保障了兒童臨床合理(lǐ)用(yòng)藥。
27.鹽酸氨溴索噴霧劑,适用(yòng)于治療2-6歲兒童的痰液粘稠及排痰困難。本品種為(wèi)适合兒童使用(yòng)劑型的改良型新(xīn)藥,相對于口服制劑,可(kě)以避免遺撒和嘔吐,對于年齡小(xiǎo)且不配合服藥的兒童而言,具有更好的順應性,其獲批上市可(kě)豐富兒童患者的治療選擇。
28.鹽酸頭孢卡品酯顆粒,适用(yòng)于兒童對頭孢卡品敏感的菌所緻的下列感染:皮膚軟組織感染、淋巴管和淋巴節炎、慢性膿皮病;咽炎、喉炎、扁桃體(tǐ)炎(包括扁桃體(tǐ)周炎,扁桃體(tǐ)周膿腫)、急性支氣管炎、肺炎;膀胱炎、腎盂腎炎;中耳炎、鼻窦炎;猩紅熱。本品種為(wèi)第三代口服頭孢菌素類抗菌藥物(wù),劑型具有較高的用(yòng)藥依從性,适合兒童尤其是嬰幼兒使用(yòng),其獲批上市可(kě)為(wèi)兒童患者提供一種有效的治療選擇。
公共衛生用(yòng)藥:
29.四價流感病毒裂解疫苗,适用(yòng)于3歲及以上人群預防疫苗相關型别的流感病毒引起的流行性感冒。本品種為(wèi)使用(yòng)世界衛生組織推薦的甲型(H1N1和H3N2)和乙型(B/Victoria和B/Yamagata)流行性感冒病毒株制成的裂解疫苗,國(guó)内既往使用(yòng)的流感疫苗以三價流感病毒裂解疫苗為(wèi)主,本品種在此基礎上增加了一種乙型流感抗原,以增加對乙型流感的抗體(tǐ)保護率和陽轉率,其獲批上市有助于進一步緩解四價流感疫苗供不應求的矛盾。
30.ACYW135群腦膜炎球菌多(duō)糖結合疫苗(CRM197載體(tǐ)),适用(yòng)于預防A群、C群、Y群和W135群腦膜炎奈瑟球菌引起的流行性腦脊髓膜炎。本品種為(wèi)國(guó)内首個批準上市的四價腦膜炎多(duō)糖結合疫苗,其獲批上市可(kě)填補國(guó)内2歲以下兒童無Y群、W135群腦膜炎多(duō)糖結合疫苗可(kě)用(yòng)的空白。
31.凍幹人用(yòng)狂犬病疫苗(Vero細胞),适用(yòng)于預防狂犬病。目前國(guó)内僅兩家企業疫苗獲批四劑免疫程序,其餘均為(wèi)五劑免疫程序,本品種同時申報五劑免疫程序和2-1-1四劑免疫程序,其獲批上市可(kě)進一步緩解狂犬病疫苗市場短缺現象。
抗腫瘤藥物(wù):
32.甲磺酸伏美替尼片,适用(yòng)于既往經EGFR酪氨酸激酶抑制劑治療時或治療後出現疾病進展,并且經檢測确認存在EGFR T790M突變陽性的局部晚期或轉移性非小(xiǎo)細胞性肺癌(NSCLC)成人患者的治療。本品種是我國(guó)自主研發并擁有自主知識産權的1類創新(xīn)藥,為(wèi)第三代表皮生長(cháng)因子受體(tǐ)(EGFR)激酶抑制劑,其獲批上市為(wèi)患者提供了新(xīn)的治療選擇。
33.普拉替尼膠囊,适用(yòng)于既往接受過含鉑化療的轉染重排(RET)基因融合陽性的局部晚期或轉移性非小(xiǎo)細胞性肺癌(NSCLC)成人患者的治療。本品為(wèi)受體(tǐ)酪氨酸激酶RET(Rearranged during Transfection)抑制劑的1類創新(xīn)藥,可(kě)選擇性抑制RET激酶活性,可(kě)劑量依賴性抑制RET及其下遊分(fēn)子磷酸化,有效抑制表達RET(野生型和多(duō)種突變型)的細胞增殖,其獲批上市為(wèi)患者提供了新(xīn)的治療選擇。
34.賽沃替尼片,适用(yòng)于治療含鉑化療後疾病進展或不耐受标準含鉑化療的、具有間質(zhì)-上皮轉化因子(MET)外顯子14跳變的局部晚期或轉移性非小(xiǎo)細胞肺癌成人患者。本品種是我國(guó)擁有自主知識産權的1類創新(xīn)藥,為(wèi)我國(guó)首個獲批的特異性靶向MET激酶的小(xiǎo)分(fēn)子抑制劑,可(kě)選擇性抑制MET激酶的磷酸化,對MET 14号外顯子跳變的腫瘤細胞增殖有明顯的抑制作(zuò)用(yòng),其獲批上市為(wèi)患者提供了新(xīn)的治療選擇。
35.舒格利單抗注射液,适用(yòng)于聯合培美曲塞和卡鉑用(yòng)于表皮生長(cháng)因子受體(tǐ)(EGFR)基因突變陰性和間變性淋巴瘤激酶(ALK)陰性的轉移性非鱗狀非小(xiǎo)細胞肺癌患者的一線(xiàn)治療,以及聯合紫杉醇和卡鉑用(yòng)于轉移性鱗狀非小(xiǎo)細胞肺癌患者的一線(xiàn)治療。本品為(wèi)重組抗PD-L1全人源單克隆抗體(tǐ),可(kě)阻斷PD-L1與T細胞上PD-1和免疫細胞上CD80間的相互作(zuò)用(yòng),通過消除PD-L1對細胞毒性T細胞的免疫抑制作(zuò)用(yòng),發揮抗腫瘤作(zuò)用(yòng),其獲批上市為(wèi)患者提供了新(xīn)的治療選擇。
36.優替德(dé)隆注射液,适用(yòng)于聯合卡培他(tā)濱,治療既往接受過至少一種化療方案的複發或轉移性乳腺癌患者。本品種是我國(guó)自主研發并擁有自主知識産權的1類創新(xīn)藥,為(wèi)埃坡黴素類衍生物(wù),可(kě)促進微管蛋白聚合并穩定微管結構,誘導細胞凋亡,其獲批上市為(wèi)患者提供了新(xīn)的治療選擇。
37.羟乙磺酸達爾西利片,适用(yòng)于聯合氟維司群,治療既往接受内分(fēn)泌治療後出現疾病進展的激素受體(tǐ)陽性、人表皮生長(cháng)因子受體(tǐ)2陰性的複發或轉移性乳腺癌患者。本品種是一種周期蛋白依賴性激酶4和6(CDK4和CDK6)抑制劑的1類創新(xīn)藥,可(kě)降低CDK4和CDK6信号通路下遊的視網膜母細胞瘤蛋白磷酸化水平,并誘導細胞G1期阻滞,從而抑制腫瘤細胞的增殖。其獲批上市為(wèi)患者提供了新(xīn)的治療選擇。
38.帕米帕利膠囊,适用(yòng)于既往經過二線(xiàn)及以上化療的伴有胚系BRCA(gBRCA)突變的複發性晚期卵巢癌、輸卵管癌或原發性腹膜癌患者的治療。本品種為(wèi)PARP-1和PARP-2的強效、選擇性抑制劑1類創新(xīn)藥,通過抑制腫瘤細胞DNA單鏈損傷的修複和同源重組修複缺陷,對腫瘤細胞起到合成緻死的作(zuò)用(yòng),尤其對攜帶BRCA基因突變的DNA修複缺陷型腫瘤細胞敏感度高。其獲批上市為(wèi)患者提供了新(xīn)的治療選擇。
39.甲苯磺酸多(duō)納非尼片,适用(yòng)于既往未接受過全身系統性治療的不可(kě)切除肝細胞癌患者。本品種是我國(guó)自主研發并擁有自主知識産權的1類創新(xīn)藥,為(wèi)多(duō)激酶抑制劑類小(xiǎo)分(fēn)子抗腫瘤藥物(wù),其獲批上市為(wèi)患者提供了一種新(xīn)的治療選擇。
40.注射用(yòng)維迪西妥單抗,适用(yòng)于至少接受過2種系統化療的人表皮生長(cháng)因子受體(tǐ)-2過表達局部晚期或轉移性胃癌(包括胃食管結合部腺癌)患者的治療。本品種為(wèi)我國(guó)自主研發的創新(xīn)抗體(tǐ)偶聯藥物(wù)(ADC),包含人表皮生長(cháng)因子受體(tǐ)-2(HER2)抗體(tǐ)部分(fēn)、連接子和細胞毒藥物(wù)單甲基澳瑞他(tā)汀E(MMAE),其獲批上市為(wèi)患者提供了新(xīn)的治療選擇。
41.阿基侖賽注射液,适用(yòng)于治療既往接受二線(xiàn)或以上系統性治療後複發或難治性大B細胞淋巴瘤成人患者(包括彌漫性大B細胞淋巴瘤非特指型、原發縱膈大B細胞淋巴瘤、高級别B細胞淋巴瘤和濾泡淋巴瘤轉化的彌漫性大B細胞淋巴瘤)。本品種為(wèi)我國(guó)首個批準上市的細胞治療類産品,是一種自體(tǐ)免疫細胞注射劑,由攜帶CD19 CAR基因的逆轉錄病毒載體(tǐ)進行基因修飾的自體(tǐ)靶向人CD19嵌合抗原受體(tǐ)T細胞(CAR-T)制備,其獲批上市為(wèi)患者提供了新(xīn)的治療選擇。
42.瑞基奧侖賽注射液,适用(yòng)于治療經過二線(xiàn)或以上系統性治療後成人患者的複發或難治性大B細胞淋巴瘤。本品種是我國(guó)首款自主研發的以及中國(guó)第二款獲批上市的細胞治療類産品,為(wèi)靶向CD19的自體(tǐ)CAR-T細胞免疫治療産品,其獲批上市為(wèi)患者提供了新(xīn)的治療選擇。
43.奧雷巴替尼片,适用(yòng)于治療任何酪氨酸激酶抑制劑耐藥,并采用(yòng)經充分(fēn)驗證的檢測方法診斷為(wèi)伴有T315I突變的慢性髓細胞白血病慢性期或加速期的成年患者。本品種為(wèi)我國(guó)自主研發并擁有自主知識産權的1類創新(xīn)藥,是小(xiǎo)分(fēn)子蛋白酪氨酸激酶抑制劑,可(kě)有效抑制Bcr-Abl酪氨酸激酶野生型及多(duō)種突變型的活性,可(kě)抑制Bcr-Abl酪氨酸激酶及下遊蛋白STAT5和Crkl的磷酸化,阻斷下遊通路活化,誘導Bcr-Abl陽性、Bcr-Abl T315I突變型細胞株的細胞周期阻滞和調亡,是國(guó)内首個獲批伴有T315I突變的慢性髓細胞白血病适應症的藥品,其獲批上市為(wèi)因T315I突變導緻耐藥的患者提供了有效的治療手段。
44.恩沃利單抗注射液,适用(yòng)于不可(kě)切除或轉移性微衛星高度不穩定(MSI-H)或錯配修複基因缺陷型(dMMR)的成人晚期實體(tǐ)瘤患者的治療,包括既往經過氟尿嘧啶類、奧沙利鉑和伊立替康治療後出現疾病進展的晚期結直腸癌患者以及既往治療後出現疾病進展且無滿意替代治療方案的其他(tā)晚期實體(tǐ)瘤患者。本品種為(wèi)我國(guó)自主研發的創新(xīn)PD-L1抗體(tǐ)藥物(wù),為(wèi)重組人源化PD-L1單域抗體(tǐ)Fc融合蛋白注射液,可(kě)結合人PD-L1蛋白,并阻斷其與受體(tǐ)PD-1的相互作(zuò)用(yòng),解除腫瘤通過PD-1/PD-L1途徑對T細胞的抑制作(zuò)用(yòng),調動免疫系統的抗腫瘤活性殺傷腫瘤,其獲批上市為(wèi)患者提供了新(xīn)的治療選擇。
抗感染藥物(wù):
45.阿茲夫定片,與核苷逆轉錄酶抑制劑及非核苷逆轉錄酶抑制劑聯用(yòng),适用(yòng)于治療高病毒載量的成年HIV-1感染患者。本品種是新(xīn)型核苷類逆轉錄酶和輔助蛋白Vif抑制劑的1類創新(xīn)藥,也是首個上述雙靶點抗HIV-1藥物(wù),能(néng)夠選擇性進入HIV-1靶細胞外周血單核細胞中的CD4細胞或CD14細胞,發揮抑制病毒複制功能(néng)。其獲批上市為(wèi)HIV-1感染者提供了新(xīn)的治療選擇。
46.艾諾韋林片,适用(yòng)于與核苷類抗逆轉錄病毒藥物(wù)聯合使用(yòng),治療成人HIV-1感染初治患者。本品種為(wèi)HIV-1新(xīn)型非核苷類逆轉錄酶抑制劑的1類創新(xīn)藥,通過非競争性結合HIV-1逆轉錄酶抑制HIV-1的複制,其獲批上市為(wèi)HIV-1感染患者提供了新(xīn)的治療選擇。
47.艾米替諾福韋片,适用(yòng)于治療慢性乙型肝炎成人患者。本品種是我國(guó)自主研發并擁有自主知識産權的1類創新(xīn)藥,為(wèi)核苷類逆轉錄酶抑制劑,其獲批上市為(wèi)慢性乙型肝炎患者提供了新(xīn)的治療選擇。
48-49.甲苯磺酸奧馬環素片、注射用(yòng)甲苯磺酸奧馬環素,适用(yòng)于治療社區(qū)獲得性細菌性肺炎(CABP)、急性細菌性皮膚和皮膚結構感染(ABSSSI)。甲苯磺酸奧馬環素為(wèi)新(xīn)型四環素類抗菌藥,具有廣譜抗菌活性,以及口服和靜脈輸注兩種劑型,其獲批上市豐富了患者的治療選擇,提高了藥品可(kě)及性。
50.康替唑胺片,适用(yòng)于治療對康替唑胺敏感的金黃色葡萄球菌(甲氧西林敏感和耐藥的菌株)、化膿性鏈球菌或無乳鏈球菌引起的複雜性皮膚和軟組織感染。本品種是我國(guó)自主研發并擁有自主知識産權的1類創新(xīn)藥,為(wèi)全合成的新(xīn)型噁唑烷酮類抗菌藥,其獲批上市為(wèi)患者提供了新(xīn)的治療選擇。
51.蘋果酸奈諾沙星氯化鈉注射液,适用(yòng)于治療對奈諾沙星敏感的肺炎鏈球菌、金黃色葡萄球菌、流感嗜血杆菌、副流感嗜血杆菌、卡他(tā)莫拉菌、肺炎克雷伯菌、銅綠假單胞菌以及肺炎支原體(tǐ)、肺炎衣原體(tǐ)和嗜肺軍團菌所緻的成人(≥18歲)社區(qū)獲得性肺炎。本品種為(wèi)無氟喹諾酮類抗菌藥,與含氟喹諾酮類抗菌藥具有不同的作(zuò)用(yòng)位點,其獲批上市可(kě)為(wèi)患者提供新(xīn)的治療選擇。
52.注射用(yòng)磷酸左奧硝唑酯二鈉,适用(yòng)于治療腸道和肝髒嚴重的阿米巴病、奧硝唑敏感厭氧菌引起的手術後感染和預防外科(kē)手術導緻的敏感厭氧菌感染。本品種屬于最新(xīn)一代硝基咪唑類抗感染藥,其獲批上市可(kě)為(wèi)厭氧菌感染的治療和預防提供新(xīn)的治療選擇。
内分(fēn)泌系統藥物(wù):
53.西格列他(tā)鈉片,适用(yòng)于配合飲食控制和運動,改善成人2型糖尿病患者的血糖控制。本品種是我國(guó)自主研發并擁有自主知識産權的1類創新(xīn)藥,為(wèi)過氧化物(wù)酶體(tǐ)增殖物(wù)激活受體(tǐ)(PPAR)全激動劑,能(néng)同時激活PPAR三個亞型受體(tǐ)(α、γ和δ),并誘導下遊與胰島素敏感性、脂肪酸氧化、能(néng)量轉化和脂質(zhì)轉運等功能(néng)相關的靶基因表達,抑制與胰島素抵抗相關的PPARγ受體(tǐ)磷酸化,其獲批上市為(wèi)患者提供了新(xīn)的治療選擇。
54.脯氨酸恒格列淨片,适用(yòng)于改善成人2型糖尿病患者的血糖控制。本品種是我國(guó)自主研發并擁有自主知識産權的1類創新(xīn)藥,為(wèi)鈉-葡萄糖協同轉運蛋白2(SGLT2)抑制劑,通過抑制SGLT2,減少腎小(xiǎo)管濾過的葡萄糖的重吸收,降低葡萄糖的腎阈值,從而增加尿糖排洩。其獲批上市為(wèi)患者提供新(xīn)的治療選擇。
循環系統藥物(wù):
55.海博麥布片,适用(yòng)于作(zuò)為(wèi)飲食控制以外的輔助治療,可(kě)單獨或與HMG-CoA還原酶抑制劑(他(tā)汀類)聯合用(yòng)于治療原發性(雜合子家族性或非家族性)高膽固醇血症,可(kě)降低總膽固醇、低密度脂蛋白膽固醇、載脂蛋白B水平。本品種為(wèi)我國(guó)自主研發并擁有自主知識産權的1類創新(xīn)藥,可(kě)抑制甾醇載體(tǐ)Niemann-Pick C1-like1(NPC1L1)依賴的膽固醇吸收,從而減少小(xiǎo)腸中膽固醇向肝髒轉運,降低血膽固醇水平,降低肝髒膽固醇貯量,其獲批上市為(wèi)原發性高膽固醇血症患者提供了新(xīn)的治療選擇。
血液系統藥物(wù):
56.海曲泊帕乙醇胺片,适用(yòng)于因血小(xiǎo)闆減少和臨床條件導緻出血風險增加的既往對糖皮質(zhì)激素、免疫球蛋白等治療反應不佳的慢性原發免疫性血小(xiǎo)闆減少症成人患者,以及對免疫抑制治療療效不佳的重型再生障礙性貧血(SAA)成人患者。本品種是我國(guó)自主研發并擁有自主知識産權的1類創新(xīn)藥,為(wèi)小(xiǎo)分(fēn)子人血小(xiǎo)闆生成素受體(tǐ)激動劑,其獲批上市為(wèi)患者提供了新(xīn)的治療選擇。
風濕性疾病及免疫藥物(wù):
57.注射用(yòng)泰它西普,适用(yòng)于與常規治療聯合用(yòng)于在常規治療基礎上仍具有高疾病活動的活動性、自身抗體(tǐ)陽性的系統性紅斑狼瘡(SLE)成年患者。本品種為(wèi)我國(guó)自主研發的創新(xīn)治療用(yòng)生物(wù)制品,可(kě)将B淋巴細胞刺激因子(BLyS)受體(tǐ)跨膜蛋白活化物(wù)(TACI)的胞外特定的可(kě)溶性部分(fēn),與人免疫球蛋白G1(IgG1)的可(kě)結晶片段(Fc)構建成的融合蛋白,由于TACI受體(tǐ)對BLyS和增殖誘導配體(tǐ)(APRIL)具有很(hěn)高的親和力,本品種可(kě)以阻止BLyS和APRIL與它們的細胞膜受體(tǐ)、B細胞成熟抗原、B細胞活化分(fēn)子受體(tǐ)之間的相互作(zuò)用(yòng),從而達到抑制BLyS和APRIL的生物(wù)學(xué)活性的作(zuò)用(yòng),其獲批上市為(wèi)患者提供了新(xīn)的治療選擇。
皮膚五官藥物(wù):
58.阿普米司特片,适用(yòng)于治療符合接受光療或系統治療指征的中度至重度斑塊狀銀屑病的成人患者。本品種屬臨床急需境外新(xīn)藥名單品種,是磷酸二酯酶4(PDE4)小(xiǎo)分(fēn)子抑制劑,可(kě)以通過抑制PDE4促使細胞内環磷酸腺苷(cAMP)含量升高,從而增加抗炎細胞因子,并下調炎症反應,其獲批上市可(kě)為(wèi)患者提供一種給藥便利的新(xīn)型替代治療選擇。
第六章 高效做好應急審評
2021年,新(xīn)冠肺炎疫情全球大流行仍處于發展階段,病毒不斷變異進一步增加了疫情的不确定性,我國(guó)疫情防控“外防輸入、内防反彈”壓力持續增大,人民(mín)群衆對疫苗藥品的期待不斷增高,國(guó)際社會對我國(guó)疫苗藥品安(ān)全的關注度與日俱增。在這種形勢下,黨和國(guó)家對新(xīn)冠病毒疫苗藥物(wù)審評審批工作(zuò)不斷提出更高要求,國(guó)務(wù)院副總理(lǐ)孫春蘭、國(guó)務(wù)委員肖捷親赴藥審中心調研并召開座談會。藥審中心堅持人民(mín)至上、生命至上,尊重科(kē)學(xué)、遵循規律,以高效應對疫情形勢變化的工作(zuò)機制和舉措,全力服務(wù)保障疫情防控工作(zuò)大局,持續做好新(xīn)冠病毒治療藥物(wù)、新(xīn)冠病毒疫苗應急審評審批工作(zuò),交出了滿意答(dá)卷。
(一)加速推動新(xīn)冠病毒治療藥物(wù)研發上市
藥審中心堅決有力落實孫春蘭副總理(lǐ)、肖捷國(guó)務(wù)委員調研座談會部署要求,嚴守新(xīn)冠病毒治療藥物(wù)研發安(ān)全有效标準,加快重點藥物(wù)應急審評審批,為(wèi)應對突發公共衛生事件和新(xīn)冠重大疫情提供科(kē)技(jì )保障。
一是第一時間學(xué)習傳達調研座談會議精(jīng)神,研究貫徹落實措施,梳理(lǐ)新(xīn)冠病毒藥物(wù)應急審評工作(zuò)進展情況,對重點品種按照“一藥一策一團隊”原則,逐個制定應急審評工作(zuò)方案,建立工作(zuò)機制,明确上市審評技(jì )術标準,确定上市審評工作(zuò)節點,制定上市審評倒排時間表、路線(xiàn)圖,形成《新(xīn)冠藥物(wù)上市審評工作(zuò)方案》。
二是加強研審聯動、主動指導企業,持續跟進新(xīn)冠病毒治療藥物(wù)研發進展,對于已進入Ⅲ期臨床試驗或已獲得初步臨床試驗數據提示臨床終點獲益的重點品種,依法依規做好新(xīn)冠病毒藥物(wù)審評工作(zuò),加快推動新(xīn)冠病毒藥物(wù)獲批上市。同時密切關注國(guó)際上新(xīn)冠病毒治療藥物(wù)研發、審評審批情況,做好知識儲備,以便更好的指導進口藥及國(guó)産仿制藥研發及上市申報。
三是落實申請人主體(tǐ)責任,對于申請附條件批準上市的品種,督促申請人按照承諾按時完成相關研究并遞交相關資料,做好新(xīn)冠病毒治療藥物(wù)全生命周期科(kē)學(xué)監管。
四是在中藥應急審評方面,藥審中心第一時間調集中藥技(jì )術審評骨幹力量,形成新(xīn)冠肺炎疫情中藥應急審評專項工作(zuò)小(xiǎo)組,深入了解新(xīn)冠肺炎病理(lǐ)特征、演變規律、中醫(yī)證候和辨證施治的原則,緊跟抗疫一線(xiàn)中醫(yī)藥使用(yòng)情況和研發動态,結合國(guó)家衛生健康委發布的《新(xīn)型冠狀病毒肺炎診療方案》,不斷加深對中醫(yī)藥在新(xīn)冠肺炎治療中獨特作(zuò)用(yòng)和臨床需要的認識。
五是加強對申請人的技(jì )術指導和注冊服務(wù),随研發随提交,随提交随審評,大大縮短了審評時間,進一步優化了審評流程,累計完成84項立項申請的可(kě)行性評議工作(zuò),所有立項申請均在24小(xiǎo)時内完成。在此基礎上,全天候接受相關品種申請人在研發和整理(lǐ)申報資料過程中遇到的問題并堅持做到随到随答(dá)。按照“邊審評、邊研究、邊總結”的工作(zuò)模式,充分(fēn)發揮以中醫(yī)藥院士和抗疫臨床一線(xiàn)專家為(wèi)主的特别專家組的指導作(zuò)用(yòng),完成“三方”抗疫成果轉化。
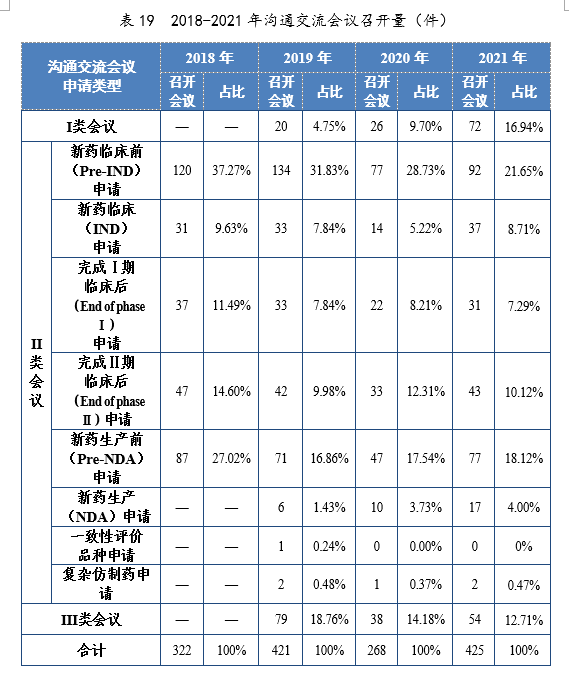
截至2021年底,累計批準55個品種新(xīn)冠病毒治療藥物(wù)IND,包括中藥2個,小(xiǎo)分(fēn)子抗病毒藥物(wù)10個,中和抗體(tǐ)30個,其他(tā)類藥物(wù)13個。2021年,新(xīn)冠病毒中和抗體(tǐ)聯合治療藥物(wù)(安(ān)巴韋單抗注射液、羅米司韋單抗注射液)、清肺排毒顆粒、化濕敗毒顆粒、宣肺敗毒顆粒已獲批上市。新(xīn)冠病毒治療藥物(wù)臨床試驗申請獲批情況詳見圖40。
(二)堅持研審聯動,創新(xīn)工作(zuò)模式,高效完成新(xīn)冠病毒疫苗應急審評工作(zuò)
藥審中心深入貫徹落實黨中央、國(guó)務(wù)院和國(guó)家局部署,持續優化“早期介入、持續跟蹤、研審聯動、科(kē)學(xué)審評”全天候應急審評審批工作(zuò)機制,積極履職擔當。
一是截至2021年底,加速推動4個新(xīn)冠病毒疫苗附條件批準上市,5條技(jì )術路線(xiàn)的27個疫苗品種獲批開展臨床試驗,其中9個進入Ⅲ期臨床試驗,新(xīn)冠病毒疫苗審評取得重大突破。
二是主動服務(wù)疫苗企業,提供全程指導,與WHO積極溝通,全力支持2款國(guó)産新(xīn)冠病毒疫苗納入WHO緊急使用(yòng)清單,取得曆史性突破,為(wèi)全面疫情防控、為(wèi)企業複工複産、推動我國(guó)經濟社會發展提供了重要保障,也為(wèi)落實習近平總書記“疫苗作(zuò)為(wèi)全人類公共産品”的承諾提供了堅實支撐,展現了疫苗應急審評審批的“中國(guó)質(zhì)量”和“大國(guó)擔當”,為(wèi)全球攜手戰勝疫情注入了強大信心。
三是積極推進新(xīn)冠病毒疫苗擴産保質(zhì)保供相關工作(zuò),創新(xīn)工作(zuò)模式,深入江蘇、北京、安(ān)徽等地新(xīn)冠病毒疫苗生産企業進行現場指導、現場辦公,研究解決技(jì )術問題,高效完成擴産能(néng)應急審評工作(zuò),全面提升我國(guó)疫苗年産能(néng)達數十億劑,擴大了疫苗的可(kě)及性和可(kě)負擔性,有效地保障了人民(mín)群衆的接種需求。
四是繼續強化服務(wù)指導,持續跟進各技(jì )術路線(xiàn)新(xīn)冠病毒疫苗研發進展,尤其是重點跟進重組蛋白類、核酸類新(xīn)冠病毒疫苗臨床試驗進展情況,依法依規做好新(xīn)冠病毒疫苗審評工作(zuò),推動更多(duō)新(xīn)冠病毒疫苗獲批上市,為(wèi)抗擊疫情擴充“武器庫”,補充“彈藥”。
五是密切關注新(xīn)冠病毒流行株的變化情況,指導督促企業開展相關研究,及時調整研發策略,鼓勵開展針對變異株新(xīn)冠病毒疫苗研發并提供技(jì )術指導,為(wèi)後續疫情防控提供支撐。
六是督促新(xīn)冠病毒疫苗上市許可(kě)持有人,落實主體(tǐ)責任,完成附條件批準時要求的各項相關任務(wù),持續深化對附條件上市産品安(ān)全性特征的認識。
七是積極參加WHO、國(guó)際藥品監管機構聯盟(ICMRA)等組織召開的視頻電(diàn)話會議,共同探讨研發與評價标準,推動我國(guó)新(xīn)冠病毒疫苗研發注冊标準與國(guó)際接軌,為(wèi)中國(guó)新(xīn)冠病毒疫苗走向世界打下了堅實基礎,為(wèi)助力全球抗疫貢獻了寶貴的中國(guó)藥監智慧、中國(guó)藥審力量。截至2021年底,藥審中心累計派員參加WHO相關會議71場,參加ICMRA相關會議49場。
在高效完成應急審評工作(zuò)的同時,藥審中心及時梳理(lǐ)應急審評中好經驗好做法,完善現有審評工作(zuò)流程,探索制定加快創新(xīn)藥上市申請的工作(zuò)機制和程序,加快新(xīn)藥新(xīn)疫苗上市,不斷滿足人民(mín)群衆的健康需求。
第七章 持續深化審評審批制度改革
(一)多(duō)措并舉滿足兒童用(yòng)藥臨床急需、促進兒童用(yòng)藥研發創新(xīn)
“支持研發嚴格監管兒童藥”是國(guó)家局黨史學(xué)習教育“我為(wèi)群衆辦實事”實踐活動“藥品監管惠企利民(mín)十大項目”之一。為(wèi)切實解決人民(mín)群衆“急難愁盼”的用(yòng)藥問題,藥審中心多(duō)措并舉,精(jīng)準發力,謀劃解決兒童用(yòng)藥研發重點、難點問題,鼓勵和促進兒童用(yòng)藥的研發創新(xīn),不斷滿足臨床需求。
創新(xīn)兒童用(yòng)藥審評管理(lǐ)工作(zuò)機制。藥審中心成立兒童用(yòng)藥專項領導小(xiǎo)組和工作(zuò)小(xiǎo)組,形成任務(wù)統一部署、力量統籌調配、工作(zuò)一體(tǐ)推進的工作(zuò)格局,有效提高了發現問題、解決問題的能(néng)力。
深入調研,協調各方共破兒童用(yòng)藥難題。解決兒童用(yòng)藥難的問題,需要監管部門、臨床機構和藥品生産企業同向發力。藥審中心多(duō)次前往國(guó)家兒童醫(yī)學(xué)中心和科(kē)研企業進行調研座談,以臨床需求為(wèi)導向共同研究和解決兒童用(yòng)藥研發、使用(yòng)和審評中的技(jì )術問題,提升我國(guó)兒童用(yòng)藥研發和科(kē)學(xué)監管水平。
落實兒童用(yòng)藥優先審評審批政策,提高兒童用(yòng)藥安(ān)全性和可(kě)及性。藥審中心堅持“高标準、嚴要求、強服務(wù)”的原則,借鑒新(xīn)冠病毒治療藥物(wù)等應急審評審批經驗,在審評系統中設立“兒童用(yòng)藥”特殊标識,優化審評資源配置,專人對接,加快兒童用(yòng)藥上市速度。2021年共有24件适用(yòng)于兒童的藥品上市許可(kě)申請通過優先審評審批程序獲批上市。
完善兒童用(yòng)藥審評标準體(tǐ)系,指導科(kē)學(xué)研發。藥審中心按照“急用(yòng)先行”的原則,結合臨床實際、借鑒國(guó)際經驗、集中專家智慧、大膽探索實踐,建立了包含真實世界數據支持等指導原則在内的兒童用(yòng)藥研發審評證據體(tǐ)系。截至2021年底共發布了《兒童用(yòng)藥(化學(xué)藥品)藥學(xué)開發指導原則(試行)》《真實世界研究支持兒童用(yòng)藥物(wù)研發與審評的技(jì )術指導原則(試行)》《注意缺陷多(duō)動障礙(ADHD)藥物(wù)臨床試驗技(jì )術指導原則》等12項兒童用(yòng)藥專項指導原則,完善了兒童用(yòng)藥臨床試驗和安(ān)全性評價标準,為(wèi)研發和審評提供了重要技(jì )術支持與審評依據,激發了企業研發活力,更好地指導了兒童用(yòng)藥的科(kē)學(xué)研發。
開展已上市藥品說明書中兒童用(yòng)藥信息規範化增補工作(zuò),保障兒童臨床科(kē)學(xué)用(yòng)藥。藥審中心着力改善兒科(kē)臨床中普遍存在的超說明書使用(yòng)現狀,破解“兒童吃藥靠掰,用(yòng)量靠猜”的困局。會同國(guó)家兒童醫(yī)學(xué)中心及其醫(yī)聯體(tǐ)成員單位,設立“中國(guó)兒童說明書規範化項目”,充分(fēn)利用(yòng)兒童醫(yī)療機構數據資源,采用(yòng)真實世界研究方法,篩選出建議修訂說明書的品種名單和具體(tǐ)修訂内容,現已公布兩批修訂說明書的品種名單。
加強兒童用(yòng)藥的政策宣傳與培訓力度。藥審中心于2021年6月1日在網站開設了“兒童用(yòng)藥專欄”,及時公布與兒童用(yòng)藥相關的政策法規、指導原則、培訓資料、品種批準信息等内容,集中展示了我國(guó)兒童用(yòng)藥審評工作(zuò),加強政策解讀和宣傳。人民(mín)日報刊發了《多(duō)舉措鼓勵兒童用(yòng)藥研發生産——滿足用(yòng)藥需求 保障用(yòng)藥安(ān)全》,中國(guó)醫(yī)藥報社刊發了《全力破解兒童用(yòng)藥短缺難題》。
(二)完善臨床試驗管理(lǐ)制度、提高藥物(wù)臨床研究質(zhì)量
1.發布《中國(guó)新(xīn)藥注冊臨床試驗現狀年度報告(2020年)》
為(wèi)全面掌握中國(guó)新(xīn)藥注冊臨床試驗現狀,及時對外公開臨床試驗進展信息,為(wèi)新(xīn)藥研發、資源配置和藥品審評審批提供參考,藥審中心根據藥物(wù)臨床試驗登記與信息公示平台的新(xīn)藥臨床試驗登記信息,首次對中國(guó)新(xīn)藥注冊臨床試驗現狀進行全面彙總分(fēn)析,發布了《中國(guó)新(xīn)藥注冊臨床試驗現狀年度報告(2020年)》。
藥審中心将以中國(guó)新(xīn)藥注冊臨床試驗登記數據為(wèi)依托,聚焦監管創新(xīn),提高監管效能(néng),在推動藥品監管能(néng)力現代化中加強與業界溝通交流,增加信息透明度,助推中國(guó)新(xīn)藥臨床試驗高質(zhì)量健康發展。
2.強化新(xīn)冠病毒疫苗、治療藥物(wù)的臨床試驗進展和安(ān)全監管工作(zuò)
藥審中心嚴格按照新(xīn)冠病毒疫苗、治療藥物(wù)臨床試驗過程中監管的工作(zuò)要求,調整優化安(ān)全性監管措施,實施高頻次的藥物(wù)警戒及安(ān)全風險監管工作(zuò),加強對重點品種的安(ān)全監測與風險處理(lǐ)。截至2021年底,獲準開展臨床試驗的82個新(xīn)冠病毒疫苗、治療藥物(wù)均被納入臨床試驗安(ān)全風險管理(lǐ)的專用(yòng)通道。
3.推動《藥物(wù)警戒質(zhì)量管理(lǐ)規範》落地實施
《藥物(wù)警戒質(zhì)量管理(lǐ)規範》自2021年12月1日起正式施行,藥審中心參與了該規範及其配套文(wén)件的制定以及規範的宣貫培訓和技(jì )術解讀工作(zuò),提高申請人對藥物(wù)警戒的主體(tǐ)責任意識,助推《藥物(wù)警戒質(zhì)量管理(lǐ)規範》落地實施。
4.逐步完善臨床試驗期間藥物(wù)警戒及安(ān)全風險管理(lǐ)工作(zuò)
藥審中心緊跟國(guó)際藥物(wù)警戒新(xīn)動态,結合中國(guó)實際,不斷完善藥物(wù)警戒工作(zuò)的新(xīn)理(lǐ)論、新(xīn)方法和新(xīn)工具,積極構建藥物(wù)警戒學(xué)科(kē)發展的監管科(kē)學(xué)體(tǐ)系和工作(zuò)平台。一是優化安(ān)全信息審評程序,構建臨床試驗期間安(ān)全風險管理(lǐ)系統(CTRiMS),實現了安(ān)全信息檢測和風險處理(lǐ)的電(diàn)子化管理(lǐ),增加臨床試驗期間安(ān)全風險管理(lǐ)的協調性、有序性、規範性。二是升級符合E2B(R3)區(qū)域實施要求的藥物(wù)警戒接收系統,提升安(ān)全數據庫應用(yòng)功能(néng),推進ICH E2B(R3)和ICH E2A指導原則在我國(guó)的轉化實施。三是優化安(ān)全風險管理(lǐ)機制,組建安(ān)全信息監測小(xiǎo)組,對安(ān)全信息進行監測、識别、分(fēn)析與初步評估,形成風險處理(lǐ)意見。四是形成臨床試驗安(ān)全信息的三級風險處理(lǐ)方式,即臨床試驗風險管理(lǐ)告知信、臨床試驗風險控制通知書、暫停或終止臨床試驗通知書,持續強化藥物(wù)臨床試驗期間安(ān)全信息報告評估管理(lǐ)。
5.安(ān)全信息的風險識别能(néng)力穩步提高
2021年收到國(guó)内臨床期間可(kě)疑且非預期的嚴重不良反應(SUSAR)首次報告7197份,同比增長(cháng)54.51%;收到研發期間年度安(ān)全性報告(DSUR)2568份,同比增長(cháng)42.82%。臨床試驗登記平台登記信息15075條(包括首次登記和信息更新(xīn)登記),同比增長(cháng)22.95%。發出臨床試驗風險管理(lǐ)告知信86份、臨床試驗風險控制通知書21份,暫停臨床試驗通知書1份,建議申辦者主動暫停臨床試驗5次。
新(xīn)冠病毒疫苗和新(xīn)冠病毒治療藥物(wù)均采用(yòng)快速推進的研發模式,存在一定程度的潛在風險,且臨床試驗開展過程中短時間納入大量受試者。藥審中心始終将新(xīn)冠病毒疫苗、新(xīn)冠病毒治療藥物(wù)的安(ān)全性放在首位,對新(xīn)冠病毒疫苗、新(xīn)冠病毒治療藥物(wù)臨床試驗加大安(ān)全監管力度、提高安(ān)全監管頻次、加強風險預警、提升安(ān)全監管的靈活性,對警戒信息第一時間進行處理(lǐ),嚴守安(ān)全底線(xiàn)。确保了臨床試驗風險可(kě)控、受試者安(ān)全,盡早滿足了公衆對新(xīn)冠病毒疫苗和新(xīn)冠病毒治療藥物(wù)用(yòng)藥安(ān)全的需求。
(三)建設中國(guó)上市藥品專利信息登記平台
為(wèi)貫徹落實《中共中央辦公廳、國(guó)務(wù)院辦公廳關于深化審評審批制度改革鼓勵藥品醫(yī)療器械創新(xīn)的意見》(廳字〔2017〕42号)和《國(guó)家局、國(guó)家知識産權局關于發布〈藥品專利糾紛早期解決機制實施辦法(試行)〉的公告》(2021年第89号),探索建立藥品專利糾紛早期解決機制,對符合藥品專利糾紛早期解決機制的品種,依法設置等待期、專利保護期或市場獨占期。藥審中心建設了中國(guó)上市藥品專利信息登記平台。
1.以問題為(wèi)導向,充分(fēn)聆聽社會各界意見建議
藥審中心加強溝通協調,多(duō)次邀請相關部門、業界專家召開平台建設研讨會,汲取行業專業性意見,及時發現解決問題,推進平台建設。在中國(guó)上市藥品專利信息登記平台測試期間,根據社會各界反映的問題,逐一解答(dá)并同步優化平台功能(néng)。
2.發布操作(zuò)指南等文(wén)件,提高用(yòng)戶的平台使用(yòng)體(tǐ)驗
藥審中心發布《中國(guó)上市藥品專利信息登記平台用(yòng)戶操作(zuò)指南》《中國(guó)上市藥品專利信息登記填表說明》等指導性文(wén)件,給予申請人明晰指導。2021年有325個上市許可(kě)持有人登記專利信息1476條,涉及藥品1090個;公開專利聲明959個,其中一類申明783個,二類申明65個,三類申明175個,四類申明97個,實現藥品注冊相關專利信息公開。
(四)紮實推進仿制藥一緻性評價工作(zuò)
1.持續開展參比制劑遴選工作(zuò)
藥審中心根據《藥審中心化學(xué)仿制藥參比制劑遴選工作(zuò)流程》要求,繼續規範遴選工作(zuò)流程,有效提高工作(zuò)效率,按時限完成參比制劑遴選工作(zuò)。自2017年8月開展一緻性評價工作(zuò)以來共發布參比制劑目錄49批,涉及4677個品規(1967個品種),其中包括注射劑參比制劑1253個品規(477個品種)。2021年發布參比制劑850個品規(527個品種)。
2.繼續完善優化一緻性評價工作(zuò)
2021年已通過一緻性評價331個品種。為(wèi)了更好的開展一緻性評價工作(zuò),藥審中心完成了我國(guó)上市化學(xué)藥品相關數據的梳理(lǐ)工作(zuò),對臨床價值明确無原研對照的品種、國(guó)産創新(xīn)品種、我國(guó)特有品種等進行了分(fēn)析研究,為(wèi)下一步一緻性評價工作(zuò)提供了參考。2021年制定了75個品種的藥學(xué)研究技(jì )術要求,起草(cǎo)了27項生物(wù)等效性個藥指導原則,逐步完善了審評标準體(tǐ)系。同時,藥審中心召開一緻性評價企業座談會,充分(fēn)聽取企業提出的相關意見和建議,以企業關心的痛點難點問題作(zuò)為(wèi)下一步工作(zuò)的重點。
3.優化一緻性評價專欄
在藥審中心網站中優化了“仿制藥質(zhì)量與療效一緻性評價”專欄,設專人對一緻性評價專欄進行更新(xīn)和維護,及時更新(xīn)通過一緻性評價的口服固體(tǐ)制劑品種說明書、企業研究報告及生物(wù)等效性試驗數據、參比制劑目錄、政策法規、技(jì )術指南等信息。
(五)提高藥品審評審批透明度25
一是加大審評信息公開力度,建立審評信息公開的長(cháng)效機制。藥審中心制定《藥審中心技(jì )術審評報告公開工作(zuò)規範(試行)》,發布《2020年度藥品審評報告》,提高審評工作(zuò)透明度。截至2021年底,已累計公開新(xīn)藥技(jì )術審評報告500個。二是持續推進審評信息公開。在藥審中心網站增設“突破性治療公示”等欄目,對申請人關注度高的加快品種信息予以公開,同時上線(xiàn)異議解決系統,開通對審評結論提出異議的通道,及時回應社會關切。三是不斷加強信息化建設。對藥審中心網站進行升級改造。新(xīn)增“兒童用(yòng)藥”、“行政受理(lǐ)服務(wù)”、“指導原則”、“藥品電(diàn)子通用(yòng)技(jì )術文(wén)檔(eCTD)”等專欄,增強審評信息公開的主動性,信息檢索的便利性和信息更新(xīn)的時效性,不斷滿足公衆和申請人訴求。四是深化“放管服”改革,加快實現“一網通辦”,推進藥監服務(wù)事項整體(tǐ)聯動。以建設整體(tǐ)聯動、高效便民(mín)的網上服務(wù)平台為(wèi)目标,整合内部賬戶體(tǐ)系,對接國(guó)家局網上辦事大廳,做到統一賬戶、入口和登錄。
2021年公開已承辦的注冊申請信息11546條,公示納入優先審評品種信息112個,公示納入突破性治療品種信息51個,公示溝通交流申請信息3757個,公開批準臨床默示許可(kě)申請信息2873個,公開上市藥品審評報告信息184個。公開登記審查通過、受理(lǐ)通過的原料藥、藥用(yòng)輔料和藥包材任務(wù)2524個。2021年首次實現原料藥審評進度查詢,并實現與關聯制劑的關聯查詢,公開單獨審評原料藥進度任務(wù)927個及與關聯制劑的關聯查詢任務(wù)443個,持續推進審評進度公開。
(六)推動藥品注冊申請申報電(diàn)子化
為(wèi)推進藥品注冊申請電(diàn)子申報,提高“互聯網+藥品監管”服務(wù)效能(néng),eCTD項目正式實施。一是發布技(jì )術規範,指導申請人準備eCTD申報資料。制定eCTD技(jì )術規範、實施指南等技(jì )術文(wén)件,為(wèi)申請人準備電(diàn)子申報資料提供技(jì )術指導和标準遵循。二是開展宣貫工作(zuò),提高申請人開展eCTD申報的積極性。制定宣講解讀計劃,開展對外宣講,幫助申請人理(lǐ)解eCTD技(jì )術要求和申報流程。三是做好相關信息化建設,方便申請人開展eCTD申報。建設eCTD專欄,集中公開國(guó)内外指導原則、工作(zuò)動态等,建設eCTD申報系統,對接國(guó)家局藥品業務(wù)應用(yòng)系統,打通藥品注冊申請全流程電(diàn)子化通道。四是開展信息安(ān)全評估,提高信息安(ān)全性。開展eCTD等級保護測評、密碼應用(yòng)安(ān)全性評估測評、網絡安(ān)全風險評估等,多(duō)措并舉,有效控制和降低信息安(ān)全風險。
第八章 支持推動中藥傳承創新(xīn)發展
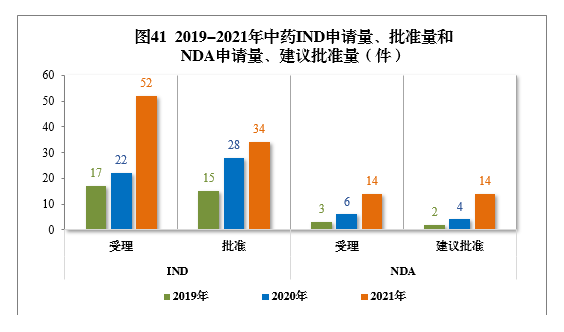
2019-2021年,中藥IND申請量(17件、24件、52件)、批準量(15件、28件、34件)和NDA申請量(3件、6件、14件)、建議批準量(2件、4件、14件)均呈現連年增長(cháng)的态勢。2019-2021年中藥IND申請量、批準量和NDA申請量、建議批準量詳見圖41。
(一)落實改革完善中藥審評審批機制要求,推動構建“三結合”26注冊審評證據體(tǐ)系
認真落實《中共中央 國(guó)務(wù)院關于促進中醫(yī)藥傳承創新(xīn)發展的意見》和習近平總書記關于改革完善中藥審評審批機制指示精(jīng)神,按照傳承精(jīng)華、守正創新(xīn)、高質(zhì)量發展的原則,深刻研究總結中藥審評審批實踐經驗和藥品審評審批制度改革成果,結合中藥特點和研發實際情況,積極主動研究中藥注冊分(fēn)類調整意見,加快構建“三結合”注冊審評證據體(tǐ)系,暢通了中藥新(xīn)藥的注冊途徑。
基于“三結合”注冊審評證據體(tǐ)系,制定審評标準和指導原則。針對“三結合”注冊審評證據體(tǐ)系下研究策略、方法的調整和溝通交流關注點,将目前已形成的人用(yòng)經驗的共識轉化到指導原則之中,發布了《中藥新(xīn)藥複方制劑中醫(yī)藥理(lǐ)論申報資料撰寫指導原則(試行)》《古代經典名方中藥複方制劑說明書撰寫指導原則(試行)》。選擇惡性腫瘤、慢性胃炎、胃食管反流病3個具體(tǐ)适應症為(wèi)突破口,引入真實世界研究等新(xīn)工具新(xīn)方法,與中醫(yī)臨床相關适應症領域的權威專家一起針對符合中醫(yī)藥特點的臨床療效評價技(jì )術要求進行研究,逐步形成指導原則。
(二)研究優化注冊分(fēn)類,開辟古代經典名方中藥複方制劑研發與審評新(xīn)路徑
藥審中心對現行《藥品注冊管理(lǐ)辦法》中藥分(fēn)類中的第3類“古代經典名方中藥複方制劑”進行了系統研究,基于“三結合”注冊審評證據體(tǐ)系思維,增加了“3.2類其他(tā)來源于古代經典名方的中藥複方制劑”分(fēn)類,并提出了一系列與之相适應的注冊管理(lǐ)要求。該分(fēn)類體(tǐ)現了傳承精(jīng)華、守正創新(xīn)的原則,有别于中藥創新(xīn)藥的研發模式,對于加快來自中醫(yī)長(cháng)期臨床實踐傳承下來的經典名方、名老中醫(yī)經驗方以及醫(yī)院制劑等的成果轉化,充分(fēn)滿足中醫(yī)臨床治療需求,具有十分(fēn)積極的意義。通過“三方”相關品種的審評,實踐了與該分(fēn)類相适應的審評程序、臨床及藥學(xué)審評要點和技(jì )術要求,得到了中醫(yī)藥院士、國(guó)醫(yī)大師等權威專家的高度贊揚。
按照國(guó)家局、國(guó)家中醫(yī)藥管理(lǐ)局工作(zuò)部署,藥審中心持續推進古代經典名方中藥複方制劑專家審評委員會的組建工作(zuò)。
(三)持續加強标準研究,構建符合中藥特點的全過程質(zhì)量控制體(tǐ)系
遵循中醫(yī)藥理(lǐ)論、傳統用(yòng)藥經驗和中藥研發規律,深入研究中藥特點和中藥審評标準,建立完善中藥新(xīn)藥全過程質(zhì)量控制體(tǐ)系,制定符合中藥特點的研究和評價技(jì )術指導原則,轉變中藥“唯成分(fēn)”的質(zhì)量控制理(lǐ)念,基本構建涵蓋藥材、飲片、制劑等的中藥新(xīn)藥全過程質(zhì)量控制體(tǐ)系和全生命周期管理(lǐ)的有關要求。發布了《中藥新(xīn)藥質(zhì)量研究技(jì )術指導原則(試行)》,該指導原則一方面重視中藥臨床長(cháng)期使用(yòng)證明安(ān)全、有效的事實,以臨床價值為(wèi)導向,尊重中醫(yī)藥傳統和特色,引導生産企業制定符合中藥特點的質(zhì)量控制方法和策略;另一方面強調“質(zhì)量源于設計”、“全過程質(zhì)量控制”等理(lǐ)念,指導生産企業更加有效地控制産品質(zhì)量。
深入研究、總結近幾十年來中藥變更研究以及中藥變更監管的經驗和成果,破除“唯成分(fēn)”的評價方式,基于生産過程、人用(yòng)經驗和質(zhì)量評價,構建了新(xīn)的變更研究評價标準,發布了《已上市中藥藥學(xué)變更研究技(jì )術指導原則(試行)》,優化已上市中藥藥學(xué)變更技(jì )術要求,解決長(cháng)期困擾企業的難點痛點問題,推動中藥産業高質(zhì)量發展。
(四)加強對申請人的指導,加快确有臨床價值的中藥新(xīn)藥審評
藥審中心将具有明顯臨床價值的中藥新(xīn)藥納入優先審評審批程序。通過問詢式溝通交流、專業問詢、線(xiàn)上視頻會議等多(duō)種方式,主動與申請人就針對關鍵技(jì )術問題的溝通交流,使申請人在專家咨詢會上答(dá)辯更為(wèi)聚焦,提高了補充資料以及說明書、質(zhì)量标準等審評所需文(wén)件撰寫的質(zhì)量和效率。全力以赴加快中藥上市許可(kě)申請審評,發揮中醫(yī)藥在疾病防治中的獨特優勢。
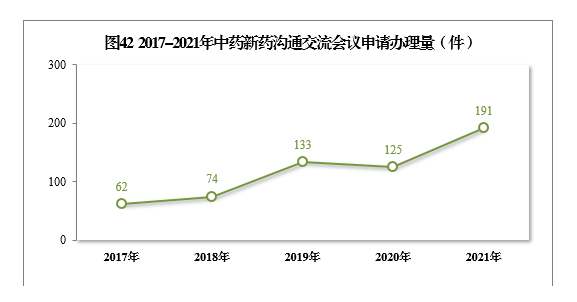
自《藥物(wù)研發與技(jì )術審評溝通交流管理(lǐ)辦法》發布以來,中藥新(xīn)藥溝通交流會議申請的辦理(lǐ)量不斷增加,從2017年62件、2018年74件,增加至2019年133件、2020年125件、2021年191件。通過與申請人的溝通交流,前置處理(lǐ)申報資料存在的問題,提高了申報資料質(zhì)量和審評工作(zuò)效率。2017-2021年中藥新(xīn)藥溝通交流會議申請辦理(lǐ)量詳見圖42。
(五)積極做好援疆援藏工作(zuò),支持促進民(mín)族藥發展
按照國(guó)家局的部署和工作(zuò)要求,藥審中心多(duō)次赴新(xīn)疆、西藏等民(mín)族地區(qū)開展調研、培訓、座談,深入了解民(mín)族藥研發實際情況和存在的問題,探索調整民(mín)族藥注冊管理(lǐ)思路,推進具有民(mín)族藥臨床治療優勢藥物(wù)的研發。通過線(xiàn)上答(dá)疑等方式解答(dá)新(xīn)疆、西藏民(mín)族藥企業咨詢問題數百條,及時解決申請人在研發和注冊過程中的問題。積極推動民(mín)族藥品種的研發,優先配置審評資源、加強注冊服務(wù)指導、做好審評全過程的溝通交流。
第九章 審評體(tǐ)系和審評能(néng)力現代化穩步提升
(一)保障連任ICH管委會成員相關工作(zuò)
ICH工作(zuò)辦公室為(wèi)保障國(guó)家局成功連任ICH管委會成員,一是争取各ICH成員的理(lǐ)解和支持,積極籌辦“ICH中國(guó)進程與展望會”,向國(guó)際行業協會全面展示了我國(guó)ICH工作(zuò)成果;組織參加了藥品信息協會(DIA)中國(guó)年會ICH主題日活動,圍繞推動ICH國(guó)際協調等議題與來自歐美日機構代表進行深入交流;與日本監管機構聯合舉辦研讨會,全面深化與國(guó)際監管機構和工業界的交流合作(zuò)。二是提高在行業代表領域的宣傳力度,2021年4月28日舉辦了“ICH指導原則實施情況宣講會”,線(xiàn)上觀看直播人數達1.4萬人次,回放1.1萬人次。三是密切關注ICH管委會選舉進程,深入研究,積極籌備ICH管委會選舉申請材料,為(wèi)國(guó)家局成功連任ICH管委會成員奠定了堅實的基礎。2021年6月3日國(guó)家局再次當選ICH管委會成員。
(二)積極推動ICH指導原則轉化實施和議題協調工作(zuò)
一是ICH工作(zuò)辦公室進一步推動ICH指導原則在國(guó)内的落地實施,2021年報請國(guó)家局發布ICH指導原則實施适用(yòng)公告6個,明确了9個ICH指導原則的實施時間節點。截至2021年底,國(guó)家局已充分(fēn)實施ICH指導原則53個,實施比例達84.13%。二是ICH工作(zuò)辦公室深入參與ICH議題協調工作(zuò)。目前ICH共有活躍議題28個,向ICH議題協調專家工作(zuò)組選派專家53人次,共參加工作(zuò)組電(diàn)話會累計達379次。
(三)流程導向科(kē)學(xué)管理(lǐ)體(tǐ)系建設更加科(kē)學(xué)
在中央紀委國(guó)家監委駐市場監管總局紀檢監察組及國(guó)家局黨組的支持和指導下,藥審中心科(kē)學(xué)管理(lǐ)體(tǐ)系8個子課題的試點建設運行良好,科(kē)學(xué)管理(lǐ)體(tǐ)系制度計劃制修訂28個,已發布制度17個,58項改革措施穩步推進。2021年藥審中心内部審評以流程為(wèi)導向的科(kē)學(xué)管理(lǐ)體(tǐ)系基本建成,制度标準體(tǐ)系和風險防控機制進一步完善、審評流程更加清晰、審評審批效率明顯提高、服務(wù)意識顯著增強、服務(wù)對象滿意度和社會美譽度明顯提高,以問題為(wèi)導向、流程為(wèi)主線(xiàn)、制度建設為(wèi)抓手的藥品審評審批工作(zuò)體(tǐ)系基本形成。同時,藥審中心總結流程導向審評體(tǐ)系的建設成果,對《藥品技(jì )術審評質(zhì)量管理(lǐ)規範》(GRP)進行了修訂。以此為(wèi)新(xīn)起點,按照推進治理(lǐ)體(tǐ)系和治理(lǐ)能(néng)力現代化新(xīn)要求,藥審中心将繼續發揮以流程導向科(kē)學(xué)體(tǐ)系建設工作(zuò)機制作(zuò)用(yòng),堅持問題導向,不斷發現新(xīn)問題,研究新(xīn)措施,持續推進審評體(tǐ)系和審評能(néng)力現代化。
(四)人才隊伍建設邁出堅實步伐
藥審中心積極開展人才隊伍建設,樹立鮮明用(yòng)人導向,堅持嚴管和厚愛結合、激勵和約束并重,鼓勵工作(zuò)人員銳意進取、擔當作(zuò)為(wèi)。一是持續加強審評隊伍和能(néng)力建設。積極協調增加人員編制,立足審評需要做好人才引進工作(zuò),充實專業審評力量,持續開展員工教育培訓,提高工作(zuò)能(néng)力。二是暢通員工職業發展通道。做好高級職稱評審申報,積極開展專業技(jì )術崗位評審聘任、主審審評員選聘,做好中級職稱以及管理(lǐ)崗位級别認定工作(zuò),破除人才職業發展瓶頸。三是不斷加強制度建設,制定《員工辭職管理(lǐ)辦法》《職工兼職(任職)管理(lǐ)辦法》《考勤與休假管理(lǐ)辦法》《因私出國(guó)(境)管理(lǐ)辦法》等11個制度,夯實了人才隊伍管理(lǐ)的基礎。四是完善績效考核等措施,進一步規範各類人員激勵和約束機制。
(五)指導規範藥品分(fēn)中心開展審評工作(zuò)
設立藥品審評檢查長(cháng)三角分(fēn)中心、藥品審評檢查大灣區(qū)分(fēn)中心(以下簡稱藥品分(fēn)中心)是黨中央、國(guó)務(wù)院在長(cháng)三角區(qū)域、粵港澳大灣區(qū)推進更高起點深化改革和更高層次對外開放等戰略部署和發展規劃的重要舉措,是對藥品審評改革創新(xīn)和藥品審評能(néng)力建設的強化支持。藥審中心在國(guó)家局的統一領導下,堅決貫徹國(guó)家區(qū)域戰略,認真落實“統一審評團隊、統一業務(wù)管理(lǐ)、統一審評系統、統一審評标準”要求,大力加強藥品分(fēn)中心建設工作(zuò)的規劃設計、建設運行及支持保障,加大業務(wù)支持指導力度,加強業務(wù)培訓,推動藥品分(fēn)中心盡快發揮應有作(zuò)用(yòng),助力區(qū)域醫(yī)藥産業高質(zhì)量發展。
一是建立藥品分(fēn)中心業務(wù)工作(zuò)協調機制。藥審中心成立專項工作(zuò)組,專題研究推進藥品分(fēn)中心業務(wù)開展、人才隊伍建設等工作(zuò),全力推進藥品分(fēn)中心逐步開展審評工作(zuò)。二是多(duō)種形式組織培訓。藥審中心通過線(xiàn)上培訓、線(xiàn)下一對一帶教等形式,對藥品分(fēn)中心人員開展了涵蓋審評任務(wù)管理(lǐ)、專家會議、溝通交流、技(jì )術審評等方面的業務(wù)培訓,促進藥品分(fēn)中心人員審評業務(wù)能(néng)力的提升。三是支持指導藥品分(fēn)中心開展溝通交流相關工作(zuò)。針對具有臨床價值的重點品種,藥審中心給予技(jì )術支持,支持藥品分(fēn)中心對區(qū)域内申請人開展指導和交流工作(zuò),2021年共組織溝通交流會議17次;發布《國(guó)家藥品監督管理(lǐ)局藥品審評檢查長(cháng)三角分(fēn)中心、大灣區(qū)分(fēn)中心關于啓動一般性技(jì )術問題解答(dá)工作(zuò)的通知》,開通申請人向藥品分(fēn)中心提交一般性技(jì )術問題端口,指導藥品分(fēn)中心解答(dá)一般性技(jì )術問題咨詢1415個。四是開展上市後變更研讨會和培訓。在上海和深圳召開了“藥品上市後變更類别确認研讨會”,建立藥審中心與藥品分(fēn)中心、省級藥監局關于上市後變更分(fēn)類确定的溝通協調機制。選派人員前往2個藥品分(fēn)中心開展藥品上市後變更指導原則的培訓,長(cháng)三角區(qū)域約兩千人參加培訓,粵港澳大灣區(qū)約五百人參加培訓。
兩個藥品分(fēn)中心挂牌運行以來,主動服務(wù),深入調研了解區(qū)域内藥品企業服務(wù)需求,積極解決企業新(xīn)藥研發與注冊中遇到的突出問題。後續藥審中心将會同兩個藥品分(fēn)中心進一步深化審評審批制度改革,有效提升藥品分(fēn)中心服務(wù)區(qū)域醫(yī)藥産業創新(xīn)發展的工作(zuò)質(zhì)量,指導支持藥品分(fēn)中心推動建設政治過硬、素質(zhì)優良、高效廉潔的審評人才隊伍。
第十章 加快完善藥品技(jì )術指導原則體(tǐ)系
近年來,随着醫(yī)藥産業迅猛發展,新(xīn)技(jì )術、新(xīn)靶點、新(xīn)機制、新(xīn)成果不斷湧現,藥品注冊申報數量持續增加,大批創新(xīn)型高科(kē)技(jì )藥物(wù)進入注冊審批程序。為(wèi)滿足藥品更新(xīn)換代速度和醫(yī)藥行業發展需求,藥品技(jì )術指導原則在具有規範性、指導性和應用(yòng)效果的同時還必須具有前瞻性。藥審中心以滿足藥物(wù)研發需求和鼓勵創新(xīn)為(wèi)目标,持續推進審評體(tǐ)系和審評能(néng)力現代化建設,緻力于構建科(kē)學(xué)權威公開的審評标準體(tǐ)系,解決影響和制約藥品創新(xīn)、質(zhì)量、效率的突出問題。
根據《國(guó)家藥監局綜合司關于印發藥品技(jì )術指導原則發布程序的通知》(藥監綜藥管〔2020〕9号)要求,藥審中心加大指導原則的起草(cǎo)制定力度,2021年經國(guó)家局審查同意發布了87個指導原則。開展藥品審評标準體(tǐ)系建設以來,已累計發布了361個指導原則,覆蓋中藥、化學(xué)藥、生物(wù)制品等領域,包含新(xīn)冠病毒治療藥物(wù)、古代經典名方、細胞和基因治療等研發熱點難點問題。目前國(guó)内指導原則已基本形成技(jì )術标準體(tǐ)系,為(wèi)醫(yī)藥産業的創新(xīn)發展和藥品審評提供了科(kē)學(xué)有力的技(jì )術支撐。2021年藥審中心完成的技(jì )術指導原則詳見附件7。
在加速推動新(xīn)冠病毒治療藥物(wù)研發上市方面,藥審中心發布了《新(xīn)型冠狀病毒中和抗體(tǐ)類藥物(wù)非臨床研究技(jì )術指導原則(試行)》《抗新(xīn)冠病毒肺炎炎症藥物(wù)非臨床藥效學(xué)研究與評價技(jì )術指導原則(試行)》《抗新(xīn)冠病毒化學(xué)藥物(wù)非臨床藥效學(xué)研究與評價技(jì )術指導原則(試行)》等指導原則,緊跟國(guó)内國(guó)際新(xīn)冠肺炎疫情的發生發展及臨床治療需求,以新(xīn)冠病毒中和抗體(tǐ)類藥物(wù)、抗新(xīn)冠病毒肺炎炎症藥物(wù)和抗新(xīn)冠病毒化學(xué)藥物(wù)作(zuò)為(wèi)抗疫藥物(wù)研發和審評審批的重點,更好地指導相關藥物(wù)的研發。
在支持推動中藥傳承創新(xīn)發展方面,發布了《古代經典名方中藥複方制劑說明書撰寫指導原則(試行)》《中藥新(xīn)藥複方制劑中醫(yī)藥理(lǐ)論申報資料撰寫指導原則(試行)》《按古代經典名方目錄管理(lǐ)的中藥複方制劑藥學(xué)研究技(jì )術指導原則(試行)》等指導原則,加快構建中醫(yī)藥理(lǐ)論、人用(yòng)經驗和臨床試驗相結合的中藥注冊審評證據體(tǐ)系,規範中醫(yī)藥理(lǐ)論申報資料和古代經典名方中藥複方制劑說明書相關内容的撰寫。
在滿足兒童用(yòng)藥臨床急需、促進兒童用(yòng)藥研發創新(xīn)方面,發布了《兒童用(yòng)化學(xué)藥品改良型新(xīn)藥臨床試驗技(jì )術指導原則(試行)》《化學(xué)藥品和治療用(yòng)生物(wù)制品說明書中兒童用(yòng)藥相關信息撰寫的技(jì )術指導原則(試行)》等指導原則,鼓勵藥物(wù)研發者研發适宜兒童使用(yòng)的劑型和規格,同時通過完善藥品說明書中兒童用(yòng)藥信息以指導臨床合理(lǐ)用(yòng)藥,持續解決臨床兒童用(yòng)藥緊缺問題。
在細胞和基因治療方面,發布了《基因修飾細胞治療産品非臨床研究技(jì )術指導原則(試行)》《基因治療産品非臨床研究與評價技(jì )術指導原則(試行)》《基因治療産品長(cháng)期随訪臨床研究技(jì )術指導原則(試行)》等指導原則,規範了國(guó)内細胞和基因治療藥物(wù)的研究與評價,進一步提高企業研發效率,引導行業健康發展。
在腫瘤藥物(wù)研發發面,發布了《以臨床價值為(wèi)導向的抗腫瘤藥物(wù)臨床研發指導原則》《生物(wù)标志(zhì)物(wù)在抗腫瘤藥物(wù)臨床研發中應用(yòng)的技(jì )術指導原則》《抗腫瘤藥首次人體(tǐ)試驗擴展隊列研究技(jì )術指導原則(試行)》等指導原則,從患者需求的角度出發,對抗腫瘤藥物(wù)的臨床研發提出建議,以期指導醫(yī)藥企業在研發過程中,落實以臨床價值為(wèi)導向、以患者為(wèi)核心的研發理(lǐ)念,促進了抗腫瘤藥物(wù)科(kē)學(xué)有序的開發。
在罕見病治療方面,發布了《罕見疾病藥物(wù)臨床研發技(jì )術指導原則》,意在促進更多(duō)低發病率疾病為(wèi)對象的藥物(wù)研發,展現了藥審中心推動我國(guó)罕見疾病藥物(wù)研發的信心和決心,力争将更多(duō)原先被市場冷落的罕見疾病藥物(wù)拉入研發快車(chē)道,為(wèi)邊緣化的罕見病患者帶來更多(duō)希望的曙光。同時針對罕見病藥物(wù)研發積極性較低的突出問題,促使醫(yī)藥企業圍繞尚未滿足的臨床需求,将罕見病作(zuò)為(wèi)創新(xīn)産品研發的重要方向之一。而最終目的,是為(wèi)了推動我國(guó)罕見病防治與保障邁上新(xīn)的台階,為(wèi)罕見病患者提供更優質(zhì)的診療服務(wù),保障人民(mín)的健康權益。
在真實世界數據方面,發布了《用(yòng)于産生真實世界證據的真實世界數據指導原則(試行)》,從審評角度明确了用(yòng)于回答(dá)臨床科(kē)學(xué)問題的數據要求,強調了真實世界數據不等同于真實世界證據,為(wèi)工業界利用(yòng)真實世界數據支持藥物(wù)研發提供了科(kē)學(xué)可(kě)行的指導意見。該指導原則的發布,使我國(guó)真實世界數據研究在政策監管層面邁向全球第一梯隊。
在藥品上市後變更方面,發布了《已上市中藥藥學(xué)變更研究技(jì )術指導原則(試行)》《已上市化學(xué)藥品藥學(xué)變更研究技(jì )術指導原則(試行)》《已上市生物(wù)制品藥學(xué)變更研究技(jì )術指導原則(試行)》等指導原則,旨在落實藥品全生命周期管理(lǐ),指導我國(guó)已上市中藥、化學(xué)藥品和生物(wù)制品藥學(xué)的變更研究,為(wèi)申請人提供可(kě)參考的技(jì )術标準。
指導原則的制定與發布進一步完善了藥品審評體(tǐ)系,為(wèi)科(kē)學(xué)公正的審評決策提供了有力的技(jì )術支撐。同時,鼓勵科(kē)研機構、申請人和行業協會更多(duō)地參與藥品指導原則編制工作(zuò),使藥品指導原則體(tǐ)系構建工作(zuò)形成良性循環,進而更好的推動我國(guó)藥品指導原則體(tǐ)系更加完善。
第十一章 黨風廉政建設見行見效
藥審中心以習近平新(xīn)時代中國(guó)特色社會主義思想為(wèi)指導,增強忠誠擁護“兩個确立”,堅定踐行“兩個維護”的政治自覺,以落實管黨治黨政治責任的有力成果,為(wèi)推進藥品審評改革創新(xīn)提供了堅強政治保障。
一是認真開展好黨史學(xué)習教育。制定《藥審中心黨委開展黨史學(xué)習教育實施方案》,召開動員部署大會,成立督導組指導各黨支部利用(yòng)“三會一課”、組織生活會等多(duō)種形式推進黨史學(xué)習教育。
二是積極開展好“我為(wèi)群衆辦實事”實踐活動。圍繞公衆和申請人急難愁盼的現實問題,将國(guó)家局“藥品監管惠企利民(mín)十大項目”中涉及藥審中心為(wèi)責任單位的4個項目作(zuò)為(wèi)工作(zuò)重點認真抓好落實,确立了加快推進新(xīn)冠病毒疫苗審評、鼓勵兒童藥研發創新(xīn)、推進審評信息公開、不斷優化溝通交流機制、持續提升服務(wù)申請人質(zhì)量等25個辦實事項目,不斷滿足業界和公衆訴求。
三是統籌抓好中央、國(guó)家局黨組巡視整改及違反中央八項規定精(jīng)神專項治理(lǐ)各項工作(zuò),通過建章立制、優化流程、加強督辦等手段協調并推動解決整改過程的難點堵點問題。通過巡視整改不斷提升整體(tǐ)工作(zuò)水平。
四是開展重點任務(wù)專項監督。對疫情防控、原輔包關聯審評審批、新(xīn)冠病毒疫苗審評審批等落實情況進行重點監督,推動藥品審評制度改革重要工作(zuò)落地見效。對于審評暫停品種的暫停原因、納入突破性療法程序的品種依程序溝通交流執行情況等開展常态監督,着力防範化解風險隐患,壓實責任。
五是持續防範和化解廉政風險。落實上級紀檢組織關于“行賄受賄一起查”要求,制定藥品注冊申請人行為(wèi)合法合規承諾書。組織員工進行利益沖突情況報告,開展員工經商辦企業持股清查工作(zuò),推動建設清正廉潔的審評審批環境。
六是堅持警示教育常态化。制定年度廉政文(wén)化建設方案,每兩月編印1期《廉潔審評教育專刊》,每月向全體(tǐ)員工推送廉潔警句,大力營造崇廉尚廉的濃厚氛圍。
第十二章 2022年重點工作(zuò)安(ān)排
過去的一年間,藥品技(jì )術審評工作(zuò)在鼓勵醫(yī)藥創新(xīn)、維護人民(mín)健康和公共衛生安(ān)全方面作(zuò)出了積極的貢獻,在保障疫情防控大局和加快醫(yī)藥産業高質(zhì)量發展中的關鍵性作(zuò)用(yòng)也愈加顯著。随着藥品審評審批制度改革不斷向縱深推進,人民(mín)群衆對藥品質(zhì)量和安(ān)全有着更高的期盼,醫(yī)藥行業對公平、有序、可(kě)預期的審評環境的訴求更加強烈,以及在全球公共衛生危機頻發、“全球新(xīn)”藥物(wù)創新(xīn)性不斷提升等複雜的社會背景下,我國(guó)藥品審評機構、藥品審評能(néng)力和藥品審評體(tǐ)系現代化方面依然面臨着諸多(duō)挑戰。
一是審評隊伍規模與審評任務(wù)量匹配失衡。目前,審評隊伍力量與每年按時限審評上萬件注冊申請任務(wù)量之間的矛盾依然突出,加班加點審評仍是常态。二是藥品審評能(néng)力現代化水平仍需全面加強。随着新(xīn)藥研發創新(xīn)全球化不斷提升,新(xīn)機制、新(xīn)靶點等“全球新(xīn)”的藥物(wù)逐漸增多(duō),創新(xīn)産品對審評能(néng)力的挑戰和壓力已日漸凸顯。三是如何更好地強化藥品審評效能(néng)、提升為(wèi)人民(mín)服務(wù)水平、建立健全現代化藥品審評體(tǐ)系的問題變得更加突出。
2022年,藥審中心将在國(guó)家局黨組的堅強領導下,緊密圍繞各項重要工作(zuò)部署,主要開展以下方面的工作(zuò)。
(一)全力保障新(xīn)冠病毒疫苗藥物(wù)審評
服務(wù)疫情防控大局,全力保障新(xīn)冠病毒疫苗擴産能(néng)、保質(zhì)量、保供應;嚴守藥物(wù)研發安(ān)全有效标準,堅持提前介入、研審聯動、科(kē)學(xué)嚴謹、依法合規,全力以赴推動新(xīn)冠病毒疫苗和治療藥物(wù)上市,持續跟進各技(jì )術路線(xiàn)疫苗藥物(wù)品種研發進展,加快促進重點藥物(wù)研發創新(xīn),督促附條件上市疫苗藥物(wù)生産企業開展上市後研究;總結固化好的經驗做法,優化應急審評工作(zuò)機制,促進應急審評工作(zuò)經驗轉化實施;加強新(xīn)冠應急審批藥物(wù)臨床試驗進展與安(ān)全信息監管。
(二)持續深化藥品審評審批制度改革
促進醫(yī)藥産業基礎性研究,支持鼓勵企業在現代醫(yī)藥新(xīn)技(jì )術、新(xīn)靶點、新(xīn)機制方面開展創新(xīn),促推解決産業創新(xīn)發展的“卡脖子”問題;堅持鼓勵以臨床價值為(wèi)導向的新(xīn)藥好藥、罕見病用(yòng)藥、重大傳染病用(yòng)藥、公共衛生方面的臨床急需藥品研發創新(xīn);細化優化突破性治療藥物(wù)、附條件批準、優先審評審批程序,促進藥品高質(zhì)量發展;支持滿足臨床需求的兒童用(yòng)藥研發創新(xīn),提高兒童用(yòng)藥的安(ān)全性和可(kě)及性;鞏固按時限審評改革成果,完善審評任務(wù)管理(lǐ)機制;強化“放管服”意識,提升溝通交流服務(wù)質(zhì)量;優化藥物(wù)臨床試驗默示許可(kě)制度;完善專家咨詢委員會工作(zuò)制度;加強藥品注冊核查檢驗溝通協調,做好《藥品注冊核查檢驗啓動工作(zuò)程序》配套制度落地實施;加強臨床試驗期間的藥物(wù)警戒體(tǐ)系建設,提升臨床試驗信息管理(lǐ)能(néng)力;穩步推進eCTD工作(zuò),提升電(diàn)子化管理(lǐ)水平。
(三)加快推動中藥審評審批機制改革
完善中藥審評審批機制,加快構建以中醫(yī)藥理(lǐ)論、人用(yòng)經驗和臨床試驗相結合的中藥審評體(tǐ)系;推進中藥技(jì )術指導原則制修訂,建立完善符合中藥特點的審評體(tǐ)系,促進中藥傳承創新(xīn)發展;加快組建古代經典名方中藥複方制劑專家審評委員會。
(四)紮實推進仿制藥質(zhì)量和療效一緻性評價
堅持标準不降低,有序推進口服固體(tǐ)制劑、注射劑一緻性評價工作(zuò);嚴格評價标準,完善相關技(jì )術指導原則體(tǐ)系;優化一緻性評價流程,加快參比制劑遴選工作(zuò),推進無參比制劑品種梳理(lǐ)及國(guó)産創新(xīn)藥自證工作(zuò)。
(五)全面開展審評體(tǐ)系和審評能(néng)力現代化建設
做好藥品安(ān)全專項整治配合工作(zuò);在國(guó)家局統一領導下加快推進藥品長(cháng)三角分(fēn)中心、藥品大灣區(qū)分(fēn)中心業務(wù)等方面建設;持續推進流程導向科(kē)學(xué)管理(lǐ)體(tǐ)系建設,完善科(kē)學(xué)審評體(tǐ)系,規範權力運行,防範各類風險;加強長(cháng)效機制建設,加快将科(kē)學(xué)管理(lǐ)體(tǐ)系的建設成果轉化為(wèi)規章制度落地落實,提升審評科(kē)學(xué)化水平,不斷提升審評質(zhì)量和審評效率;做好疫苗國(guó)家監管體(tǐ)系(NRA)評估迎檢;推進以臨床價值為(wèi)導向的指導原則建設;推進ICH指導原則轉化實施,促進國(guó)内行業監管與國(guó)際标準接軌;推進監管科(kē)學(xué)課題研究;加強法務(wù)工作(zuò),提升職工法律意識和依法決策水平;充實審評力量,優化專業結構,加強審評隊伍建設;加強業務(wù)培訓,探索完善培訓考核與評價機制。
(六)馳而不息強化黨風廉政建設
持之以恒學(xué)深悟透做實習近平新(xīn)時代中國(guó)特色社會主義思想,認真學(xué)習黨的二十大精(jīng)神,深刻認識“兩個确立”的決定性意義,堅決貫徹習近平總書記的重要講話、重要指示精(jīng)神,不斷增強“四個意識”,堅定“四個自信”,做到“兩個維護”;認真貫徹黨中央、國(guó)務(wù)院重大決策部署,鞏固落實中央八項規定精(jīng)神;持續推進“不敢腐、不能(néng)腐、不想腐”體(tǐ)制機制建設;做好防範利益沖突工作(zuò);豐富新(xīn)聞宣傳方式,打造系統化宣傳格局,弘揚藥品審評審批制度改革成果。
結 語
行之力則知愈進,知之深則行愈達。2022年,藥審中心将繼續以習近平新(xīn)時代中國(guó)特色社會主義思想為(wèi)指導,認真貫徹落實習近平總書記重要指示批示、黨的十九大和曆次全會精(jīng)神,深刻領會“兩個确立”的決定性意義,增強“四個意識”,堅定“四個自信”,堅決做到“兩個維護”,以革故鼎新(xīn)的勇氣、堅忍不拔的定力,抓好“十四五”藥品安(ān)全及高質(zhì)量發展規劃的貫徹落實,全面加強黨的建設,縱深推進全面從嚴治黨,持續深化藥品審評審批制度改革,深入開展藥品安(ān)全專項整治行動,不斷加大審評隊伍建設管理(lǐ)力度,紮實做好新(xīn)冠病毒疫苗藥物(wù)應急審評工作(zuò),大力支持中醫(yī)藥傳承創新(xīn)發展,有序推進仿制藥質(zhì)量和療效一緻性評價,不斷提升藥品審評體(tǐ)系和審評能(néng)力現代化水平,全力服務(wù)疫情防控工作(zuò)大局,切實保障人民(mín)群衆用(yòng)藥安(ān)全有效可(kě)及。
以初心,緻創新(xīn)。做好藥品審評工作(zuò)使命光榮、責任重大。藥審中心将更加緊密團結在以習近平同志(zhì)為(wèi)核心的黨中央周圍,把握大勢、搶占先機,肩負起新(xīn)時代賦予的重任,心懷“國(guó)之大者”,以不負人民(mín)的實際行動奮力開創藥品審評事業新(xīn)局面,加快建設科(kē)學(xué)、高效、權威、公衆信賴的藥品審評機構,以優異成績迎接黨的二十大勝利召開,為(wèi)守護人民(mín)生命健康和建設社會主義現代化國(guó)家、實現中華民(mín)族偉大複興的中國(guó)夢作(zuò)出新(xīn)的更大貢獻!
注解: 1此數據包含以醫(yī)療器械作(zuò)用(yòng)為(wèi)主的藥械組合産品4件,不包含原料藥;本報告中“注冊申請”的數量單位為(wèi)“件”,以受理(lǐ)号計算。 2原國(guó)家食品藥品監督管理(lǐ)總局、現國(guó)家藥品監督管理(lǐ)局在本報告中統稱為(wèi)國(guó)家局。 3包括無需技(jì )術審評的補充申請和臨時進口注冊申請。 4在受理(lǐ)需技(jì )術審評的注冊申請9235件的基數上,此數據不含藥械組合産品4件。 5包含民(mín)族藥。 6以補充申請途徑申報。藥審中心自2017年8月開始承擔仿制藥質(zhì)量和療效一緻性評價工作(zuò)。 7本章創新(xīn)藥包含按照現行《藥品注冊管理(lǐ)辦法》(國(guó)家市場監督管理(lǐ)總局令第27号)注冊分(fēn)類中藥、化藥、生物(wù)制品1類和原《藥品注冊管理(lǐ)辦法》(國(guó)家食品藥品監督管理(lǐ)局令第28号)注冊分(fēn)類中藥1-6類、化藥1.1類、生物(wù)制品1類受理(lǐ)的藥品。 8本報告中“品種”的數量單位為(wèi)“個”,均以通用(yòng)名稱計。 9化學(xué)藥5.1類為(wèi)境外上市的原研藥品和改良型藥品的境内上市。 10臨床試驗申請包括IND和驗證性臨床試驗申請。 11創新(xīn)化學(xué)藥IND 1134件(487個品種),NDA 32件(21個品種)。 12創新(xīn)生物(wù)制品IND 643件(423個品種),NDA 23件(16個品種)。 13藥物(wù)臨床試驗申請、一緻性評價申請、補充申請、境外生産藥品再注冊申請。 14自2017年5月1日,藥審中心根據《國(guó)家食品藥品監督管理(lǐ)總局關于調整部分(fēn)藥品行政審批事項審批程序的決定》(國(guó)家食品藥品監督管理(lǐ)總局令第31号),開始以國(guó)家局名義對部分(fēn)注冊申請作(zuò)出藥品行政審批決定。 15本報告所稱“審結”包括:完成技(jì )術審評報送國(guó)家局審批、完成技(jì )術審評後以國(guó)家局名義審批、不需要技(jì )術審評以國(guó)家局名義直接審批、審評審批程序終止。“審結”不包含已完成至少一輪技(jì )術審評,因需申請人補充資料、發出補充資料通知書的注冊申請(以下簡稱待申請人回複補充資料)。 16含藥械組合注冊申請8件。 17不含藥械組合注冊申請8件。 18 本報告中的原研藥,為(wèi)通過系統完整的研究,并證明安(ān)全有效、質(zhì)量可(kě)控的藥品。 19根據《國(guó)家藥品監督管理(lǐ)局、國(guó)家衛生健康委員會關于臨床急需境外新(xīn)藥審評審批相關事宜的公告》(2018年第79号),藥審中心先後遴選并發布三批臨床急需境外新(xīn)藥名單共81個品種。 20本章創新(xīn)藥包含按照現行《藥品注冊管理(lǐ)辦法》(國(guó)家市場監督管理(lǐ)總局令第27号)注冊分(fēn)類中藥、化藥、生物(wù)制品1類和原《藥品注冊管理(lǐ)辦法》(國(guó)家食品藥品監督管理(lǐ)局令第28号)注冊分(fēn)類中藥1-6類、化藥1.1類、生物(wù)制品1類審結的藥品。 21藥物(wù)臨床試驗申請、一緻性評價申請、補充申請、境外生産藥品再注冊申請及其複審注冊申請。 22無需技(jì )術審評的補充申請、臨時進口注冊申請。 23基于風險啓動的注冊核查任務(wù)不包含新(xīn)冠病毒治療藥物(wù)、新(xīn)冠病毒疫苗的現場核查、有因檢查。 24《藥審中心關于業務(wù)咨詢服務(wù)聯絡方式的通知》見藥審中心網站(www.cde.org.cn)。 25數據來源為(wèi)藥審中心網站“信息公開”專欄。 26中醫(yī)藥理(lǐ)論、人用(yòng)經驗、臨床試驗相結合的中藥注冊審評證據體(tǐ)系。
相關新(xīn)聞

美歐日醫(yī)療器械監管法律制度概覽與思考
2000年,中華人民(mín)共和國(guó)國(guó)務(wù)院令第276号公布了《醫(yī)療器械監督管理(lǐ)條例》(以下簡稱《條例》),構建了醫(yī)療器械法律制度的框架,我國(guó)醫(yī)療器械走上了依法治理(lǐ)的軌道。此後《條例》曆經多(duō)次修訂和修改。2021年施行的新(xīn)版《條例》貫徹“四個最嚴”要求,全面落實黨中央、國(guó)務(wù)院關于醫(yī)療器械審評審批制度改革精(jīng)神,為(wèi)鼓勵醫(yī)療器械産業創新(xīn)高質(zhì)量發展提供了堅實的法治保障。
2606個小(xiǎo)時之前

最暢銷的基因與細胞療法TOP10盤點
2017年是細胞和基因治療領域具有裏程碑意義的一年,在這一年裏,美國(guó)食品和藥品監督管理(lǐ)局(FDA)批準了首款CAR-T細胞療法(Kymriah)上市,還批準了首款AAV基因療法(Luxturna)上市。
2947個小(xiǎo)時之前

檢查員說 | 淺談藥物(wù)警戒檢查後企業整改常見問題及解決辦法
自2021年12月1日《藥物(wù)警戒質(zhì)量管理(lǐ)規範》(以下簡稱GVP)實施後,截至2023年底,筆(bǐ)者所在的北京市藥品不良反應監測中心針對藥品上市許可(kě)持有人開展了107家次GVP符合性檢查。檢查員在督促企業整改過程中,常常發現企業不能(néng)一次性完成整改,一些問題不能(néng)及時糾正,大大降低了檢查整改工作(zuò)效率。現對藥物(wù)警戒檢查後企業整改後出現的常見問題進行梳理(lǐ)并提出相關建議。
2947個小(xiǎo)時之前

降脂“藥王”縮水76億,3款新(xīn)藥大漲超100%!海正、魯南、京新(xīn)獨家産品突圍
血脂調節劑是心腦血管系統藥物(wù)中重要的品類之一,也是首批被國(guó)采盯上的臨床常用(yòng)藥物(wù)。經曆了國(guó)采五年時間,該類藥物(wù)的市場規模大幅縮水,2020年至今在中國(guó)公立醫(yī)療機構終端已無百億品種,新(xīn)上市産品則持續爆發活力。2023年信達生物(wù)的托萊西單抗注射液獲批,成為(wèi)近年來首個上市的血脂調節劑生物(wù)藥1類新(xīn)藥,打破了進口藥獨占市場的局面,君實、康方、恒瑞的PCSK9抑制劑正在沖刺上市,國(guó)内血脂調節劑市場又将迎來新(xīn)局面。
3061個小(xiǎo)時之前

中藥企業爆發了!28家研發費用(yòng)超84億,天士力、以嶺、康緣領跑,猛攻4200億市場
3061個小(xiǎo)時之前













