臨床試驗發展迅猛 新(xīn)藥研發勢頭喜人
——我國(guó)新(xīn)藥注冊臨床試驗進展情況分(fēn)析
發布日期:2022-06-30 閱讀次數:12116 來源:中國(guó)醫(yī)藥報
摘要:
近日,國(guó)家藥監局藥品審評中心(以下簡稱藥審中心)發布《中國(guó)新(xīn)藥注冊臨床試驗進展年度報告(2021年)》,這是藥審中心繼2021年11月發布《中國(guó)新(xīn)藥注冊臨床試驗現狀年度報告(2020年)》後,發布的第二份新(xīn)藥注冊臨床試驗情況年度報告。該報告根據藥物(wù)臨床試驗登記與信息公示平台的新(xīn)藥臨床試驗登記信息,對2021年我國(guó)新(xīn)藥注冊臨床試驗現狀進行彙總分(fēn)析,為(wèi)新(xīn)藥研發、資源配置和藥品審評審批提供了參考。
本文(wén)結合兩份報告内容,分(fēn)析近年來我國(guó)新(xīn)藥注冊臨床試驗數據變化情況。
新(xīn)藥臨床試驗項目數量再攀新(xīn)高
近年來,為(wèi)推進藥品高質(zhì)量發展,更好地滿足臨床需要,我國(guó)持續深化藥品審評審批制度改革,出台了一系列措施鼓勵藥品創新(xīn),各藥企也在政策利好下積極投入創新(xīn)研發。
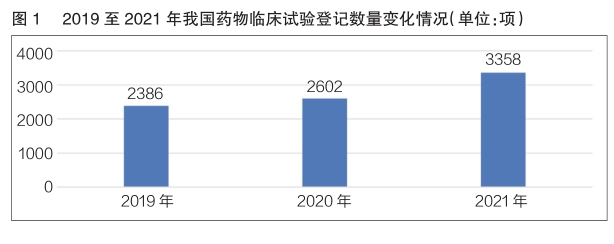
數據顯示,2019至2021年,我國(guó)藥物(wù)臨床試驗登記數量呈逐年增長(cháng)趨勢(詳見圖1)。2021年我國(guó)藥物(wù)臨床試驗年度登記總量首次突破3000項,共計3358項。其中,新(xīn)藥臨床試驗登記2033項,占比60.5%,較2020年同比增長(cháng)38.0%。
化學(xué)藥物(wù)和生物(wù)制品創新(xīn)勢頭強勁
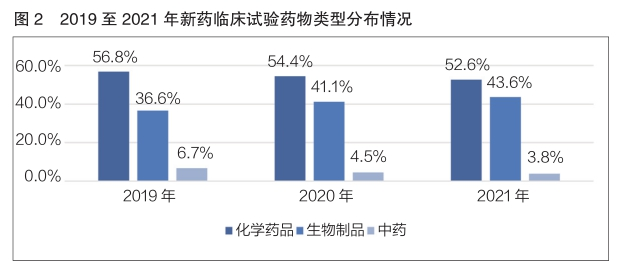
2021年,化學(xué)藥物(wù)、生物(wù)制品和中藥的新(xīn)藥臨床試驗登記數量占比分(fēn)别為(wèi)52.6%、43.6%和3.8%,對比2019至2021年三年數據,均為(wèi)化學(xué)藥物(wù)新(xīn)藥臨床試驗登記數量占比最多(duō),生物(wù)制品新(xīn)藥臨床試驗數量占比呈逐年增長(cháng)趨勢(詳見圖2)。
從新(xīn)藥臨床試驗的注冊分(fēn)類看,化學(xué)藥物(wù)和生物(wù)制品創新(xīn)勢頭強勁。
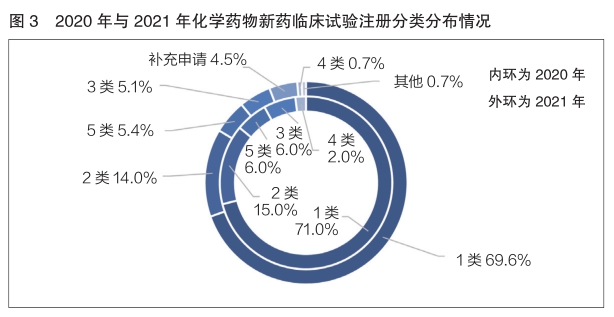
2020年與2021年登記的化學(xué)藥物(wù)新(xīn)藥臨床試驗均以1類為(wèi)主,分(fēn)别占比71.0%和69.6%,基本持平(詳見圖3)。
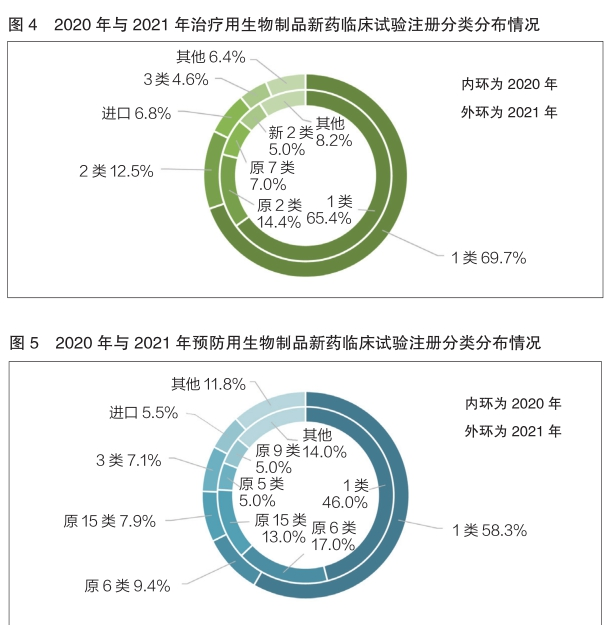
2020年與2021年登記的生物(wù)制品新(xīn)藥臨床試驗同樣以1類為(wèi)主。其中,在治療用(yòng)生物(wù)制品的新(xīn)藥臨床試驗中,2020年與2021年1類占比分(fēn)别為(wèi)65.4%和69.7%,基本持平;在預防用(yòng)生物(wù)制品的新(xīn)藥臨床試驗中,2021年1類占比為(wèi)58.3%,相較于2020年的46.0%有所增長(cháng)(詳見圖4和圖5)。
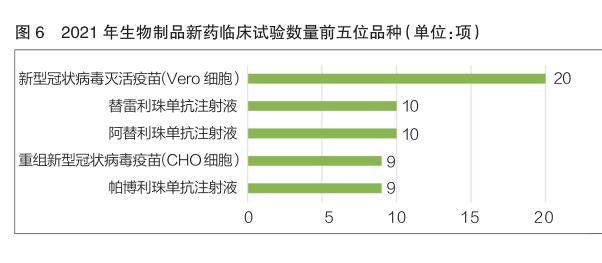
近三年來,新(xīn)型冠狀病毒疫苗成為(wèi)生物(wù)制品的研發熱點。2021年新(xīn)型冠狀病毒滅活疫苗(Ver o細胞)開展臨床試驗20項,是生物(wù)制品中新(xīn)藥臨床試驗數量最多(duō)的品種;重組新(xīn)型冠狀病毒疫苗(CHO細胞)也開展了9項臨床試驗,在生物(wù)制品新(xīn)藥臨床試驗數量排名中位列第四(詳見圖6)。
抗腫瘤藥物(wù)研發蓬勃發展
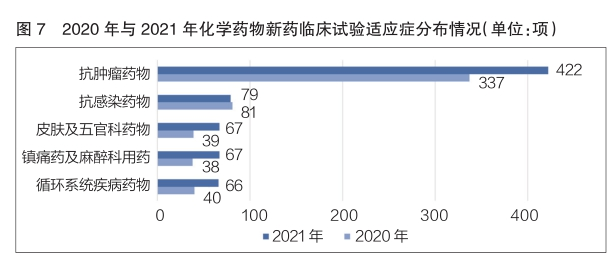
2021年,化學(xué)藥物(wù)新(xīn)藥臨床試驗數量排名前五位的适應症依次為(wèi)抗腫瘤藥物(wù)、抗感染藥物(wù)、皮膚及五官科(kē)藥物(wù)、鎮痛藥及麻醉科(kē)用(yòng)藥、循環系統疾病藥物(wù)。其中,抗腫瘤藥物(wù)以422項新(xīn)藥臨床試驗位居榜首,相較于2020年的337項,同比增長(cháng)了25.2%(詳見圖7)。
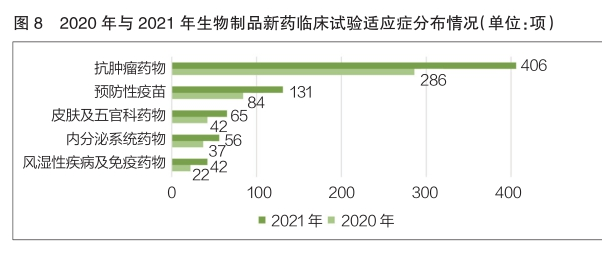
2021年,生物(wù)制品新(xīn)藥臨床試驗排名前五的适應症依次為(wèi)抗腫瘤藥物(wù)、預防性疫苗、皮膚及五官科(kē)藥物(wù)、内分(fēn)泌系統藥物(wù)、風濕性疾病及免疫藥物(wù)。其中,抗腫瘤藥物(wù)新(xīn)藥臨床試驗數量位居第一,為(wèi)406項,相較于2020年的286項,同比增長(cháng)了42.0%(詳見圖8)。
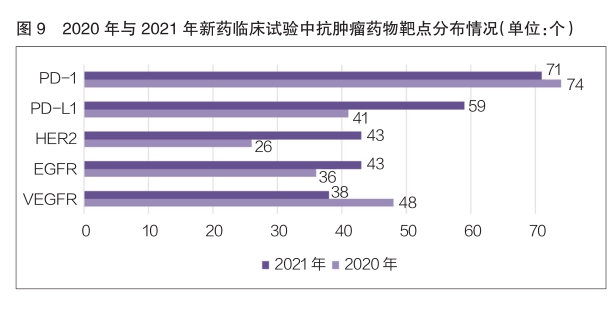
2021年,新(xīn)藥臨床試驗中抗腫瘤藥物(wù)的作(zuò)用(yòng)靶點主要為(wèi)PD-1和PDL1。其中,作(zuò)用(yòng)靶點為(wèi)PD-1的品種數量排名第一,為(wèi)71個,與2020年的74個基本持平;其次是作(zuò)用(yòng)靶點為(wèi)PD-L1的品種,數量為(wèi)59個,相較于2020年的41個,同比增長(cháng)了43.9%(詳見圖9)。
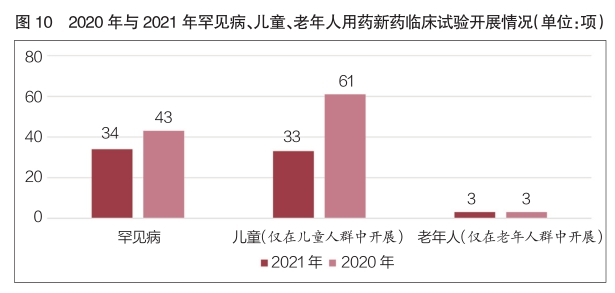
兒童、罕見病用(yòng)藥新(xīn)藥臨床試驗增多(duō)
2021年,罕見病新(xīn)藥臨床試驗共登記43項,較2020年同比增長(cháng)26.5%。含兒童受試者的新(xīn)藥臨床試驗168項,在新(xīn)藥臨床試驗登記總量中占比8.3%;其中僅在兒童人群中開展的新(xīn)藥臨床試驗61項,在新(xīn)藥臨床試驗登記總量中占比3.0%,數量較2020年同比增長(cháng)84.8%。含老年人受試者的新(xīn)藥臨床試驗共1515項,在新(xīn)藥臨床試驗登記總量中占比74.5%,占比與2020年基本持平;其中僅在老年人群中開展的新(xīn)藥臨床試驗與2020年同為(wèi)3項,适應症分(fēn)别為(wèi)帕金森病、成人内源性生長(cháng)激素分(fēn)泌不足和輕中度阿爾茨海默病(詳見圖10)。
相關新(xīn)聞

美歐日醫(yī)療器械監管法律制度概覽與思考
2000年,中華人民(mín)共和國(guó)國(guó)務(wù)院令第276号公布了《醫(yī)療器械監督管理(lǐ)條例》(以下簡稱《條例》),構建了醫(yī)療器械法律制度的框架,我國(guó)醫(yī)療器械走上了依法治理(lǐ)的軌道。此後《條例》曆經多(duō)次修訂和修改。2021年施行的新(xīn)版《條例》貫徹“四個最嚴”要求,全面落實黨中央、國(guó)務(wù)院關于醫(yī)療器械審評審批制度改革精(jīng)神,為(wèi)鼓勵醫(yī)療器械産業創新(xīn)高質(zhì)量發展提供了堅實的法治保障。
2606個小(xiǎo)時之前

最暢銷的基因與細胞療法TOP10盤點
2017年是細胞和基因治療領域具有裏程碑意義的一年,在這一年裏,美國(guó)食品和藥品監督管理(lǐ)局(FDA)批準了首款CAR-T細胞療法(Kymriah)上市,還批準了首款AAV基因療法(Luxturna)上市。
2947個小(xiǎo)時之前

檢查員說 | 淺談藥物(wù)警戒檢查後企業整改常見問題及解決辦法
自2021年12月1日《藥物(wù)警戒質(zhì)量管理(lǐ)規範》(以下簡稱GVP)實施後,截至2023年底,筆(bǐ)者所在的北京市藥品不良反應監測中心針對藥品上市許可(kě)持有人開展了107家次GVP符合性檢查。檢查員在督促企業整改過程中,常常發現企業不能(néng)一次性完成整改,一些問題不能(néng)及時糾正,大大降低了檢查整改工作(zuò)效率。現對藥物(wù)警戒檢查後企業整改後出現的常見問題進行梳理(lǐ)并提出相關建議。
2947個小(xiǎo)時之前

降脂“藥王”縮水76億,3款新(xīn)藥大漲超100%!海正、魯南、京新(xīn)獨家産品突圍
血脂調節劑是心腦血管系統藥物(wù)中重要的品類之一,也是首批被國(guó)采盯上的臨床常用(yòng)藥物(wù)。經曆了國(guó)采五年時間,該類藥物(wù)的市場規模大幅縮水,2020年至今在中國(guó)公立醫(yī)療機構終端已無百億品種,新(xīn)上市産品則持續爆發活力。2023年信達生物(wù)的托萊西單抗注射液獲批,成為(wèi)近年來首個上市的血脂調節劑生物(wù)藥1類新(xīn)藥,打破了進口藥獨占市場的局面,君實、康方、恒瑞的PCSK9抑制劑正在沖刺上市,國(guó)内血脂調節劑市場又将迎來新(xīn)局面。
3061個小(xiǎo)時之前

中藥企業爆發了!28家研發費用(yòng)超84億,天士力、以嶺、康緣領跑,猛攻4200億市場
3061個小(xiǎo)時之前













